Fonte grise,
reformage du méthane, le bronze, carbonate et hydrogénocarbonate,
butan-2-ol.
Concours
technicien de l'industrie et des Mines
2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Fonte grise.
Une
fonte grise est constituée en masse de 95, 0% de fer et de 5,0% de
carbone. Pour la fabriquer on fait réagir dans un haut fourneau de
l'oxyde de fer (III° Fe2O3(s) avec du monoxyde de
carbone CO(g) pour donner Fe(s) et du dioxyde de carbone CO2(g).
Le monoxyde de carbone utilisé est obtenu par action ménagée du
dioxygène de l'air sur du carbone C(s), le coke.
Ecrire
les équations de la réaction de production de CO et de production du fer.
C(s) + ½O2(g) = CO(g).
Fe2O3
(s) + 3CO(g) = 2Fe(s) + 3CO2(g).
Fe2O3
joue le rôle d'oxydant ( le degré d'oxydation du fer passe de
+(III) à zéro ) et CO celui de réducteur.
On
prépare annuellement 10 millions de tonnes de fonte.
A
quelle masse de fer cela correspond-il ?
mFe=10*0,95 = 9,5 millions de tonnes.
Quel
est le volume de dioxygène nécessaire à la préparation de 10 millions
de tonnes de fonte ? On donne Vm = 70 L/mol.
M(Fe) = 55,8 g/mol.
Quantité de matière de fer : n = mFe / M(Fe) = 9,5 1012/55,8
=1,7025 1011 mol.
Quantité de matière de CO : 1,5 n ; quantité de matière de dioxygène :
0,75 n ;
volume de dioxygène : 0,75 n Vm = 0,75*1,7025
1011 *70 =8,94 1012 ~8,9 1012 L.
Quelle masse de
carbone aura-t-on consommée ?
Quantité de matière de carbone : 1,5 n ;
masse de carbone : 1,5 n M(C) = 1,5*1,7025
1011 *12 =3,06 1012~3,1 1012 g.
Le dihydrogène.
Reformage du méthane
CH4 (g)+ H2O(g)=
CO(g)+ 3H2 (g).
Calculer l'enthalpie de
réaction , notée DrH°
à 298 K.
DrH° = DfH°(CO(g))-DfH°(H2O(g))-DfH°( CH4(g)).
DrH°
=-110,52-(-241,83)-(-74,85)=206,16 kJ/mol.
Calculer l'entropie
de réaction à 298 K.
DrS°
= S°(CO(g))+3S°(H2(g)-S°(H2O(g))-S°( CH4(g)).
DrS°
=197,9+3*130,6-188,7-186,2 =214,8 J K-1.
La réaction est-elle
endothermique ou exothermique ?
DrH° est positive, la
réaction est endothermique.
Expliquer
pourquoi le signe de était DrS°prévisible.
A partir de 2 moles de réactifs, il se forme 4 moles de produits : le
désordre augmente.
Calculer
la valeur de l'enthalpie libre de réaction à 298 K.
DrG° = DrH°-TDrS°
=206,16 103-298*214,8 =1,42 105 J mol-1.
En
déduire la valeur de la constante d'équilibre K à 298 K. Conclure.
DrG° =-RTln K ; lnK = -1,42 105
/(8,31*298)=-57,4 ; K ~1,2 10-25.
K est très faible ; à 298 K la réaction est très partielle dans le sens
direct.
Faut-il
avancer ou abaisser la température ( à pression constante ) pour
favoriser la réaction dans le sens direct ?
Une élévation de température ( à pression constante ) favorise une
réaction endothermique.
Que
produirait une augmentation de pression ( à température constante ) sur
l'équilibre ? Justifier.
Une augmentation de pression ( à température constante ) favorise la
réaction dans le sens indirect, diminution du nombre de moles.
En supposant DrH° et DrS°indépendant
de T, calculer
la température d'inversion de cette réaction, température pour
laquelle DrG° change de signe.
DrG° = DrH°-T
DrS°
=0 ; T = DrH°/ DrS° =206,16 103/214,8
~960 K.
|
| .
. |
|
|
Le bronze.
Enoncer la règle de
Klechlkowski et donner la configuration qui en découle pour l'atome de
cuivre.
Le remplisage des orbitales se fait suivant les valeurs croissantes de
l+n. En cas d'égalité, on remplit en premier les orbitales du n le plus
faible.
1s2
2s2 2p6 3s2 3p6 4s2
3d9.
En fait, cet atome constitue une exception à la règle de Klechkowski.
Proposer une
explication. Donner alors sa configuration électronique.
1s2
2s2 2p6 3s2 3p6 4s1
3d10.
Il
existe des exceptions liées à la stabilité particulière
des orbitales saturées ( 3 d10 dans ce cas ), au
détriment
d'autres sous-couches ( 4 s2 dans ce cas ) déjà
remplies.
Donner la
configuration électronique des ions Cu+ et Cu2+
dans leur état fondamental.
Cu+ : 1s2
2s2
2p6 3s2 3p6 3d10. Cu2+
: 1s2
2s2 2p6 3s2 3p6 3d9.
Le cuivre donne avec le soufre un composé de formule CuS. Le soufre
existe sous les degrés d'oxydation suivants : -II, 0, IV, VI. Donner un exemple
pour chacun ( nom et formule).
Sulfure d'hydrogène H2S ; soufre S ; dioxyde de soufre SO2
; acide sulfurique H2SO4.
Donner
la structure de Lewis de SO2 et H2S ;
proposer une représentation tridimentionnelle en indiquant la valeur
approximative des angles de liaisons.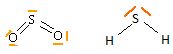
H2S
: type AX2E2,
molécule coudée, angle de liaison 92°.
SO2 : type
AX2E,
molécule coudée. angle de liaison ~119°.
Le bronze :
alliage
Cu-Sn.
Le cuivre cristallise dans le système cubique à faces centrées
(c.f.c.). Le paramètre de maille est a = 3,60 10-10 m. On
supposera que le contact se fait entre entités de cuivre supposées
sphériques.
Par ailleurs, le cuivre peut former de nombreux alliages, par insertion
ou substitution.
Représenter
le schéma de la maille du cuivre.
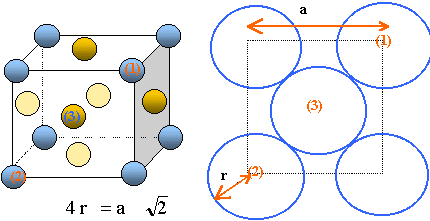
Établir la relation
entre le rayon de l’atome de cuivre, r = rCu, et le paramètre a
de la maille c.f.c. Calculer rCu.
Il
y a contact des sphères suivant la diagonale d'une face
du cube.
rCu
= 1,414 *3,60 10-10
/ 4 = 1,273 10-10 ~1,27 10-10 m.
Calculer la masse
volumique du cuivre.
Chaque
maille compte en propre :
- Chaque
atome situé au centre d'une face, donc commun à deux mailles
compte pour ½ : il y a 6 faces soit 6*0,5 = 3 atomes.
- Chaque
atome situé à un sommet, donc commun à huit mailles compte
pour 1/8 : il y a huit sommets donc 8 /8 = 1 atome.
par maille
: 3+1 = 4 atomes de cuivre.
Masse d'un
atome de cuivre : masse molaire du cuivre / nombre
d'Avogadro = 63,5 10-3/ 6,02 1023 = 1,0548 10-25
kg. Masse des
atomes de la maille 4*1,0548 10-25 =4,219 10-25
kg.
volume de
la maille a3 = (3,60 10-10)3
= 4,6656 10-29 m3.
La masse
volumique : masse / volume = 4,219 10-25
/ 4,6656 10-29 = 8,85 103 kg m-3.
Calculer la
compacité du cristal.
C'est
le rapport du volume occupé par les atomes au volume de la maille.
4 atomes de cuivre par
maille de rayon 1,273
10-10 m.
volume : 4*4 /3 *3,14 * ( 1,273
10-10)3
=3,45 10-29 m3.
volume de
la maille : (3,60
10-10
)3 =4,6656 10-29 m3.
compacité
: 3,45 10-29 / 4,6656 10-29
= 0,74.
|
.
|
|
Carbonate et hydrogénocarbonate.
Une eau industrielle contient des ions carbonates CO32- et hydrogénocarbonate HCO3- responsables de son alcalinité. La mesure du pH donne 8,4.
Tracer le
diagramme de prédominance des espèces acides et basiques des couples
auquels appartient l'ion hydrogénocarbonate.
Quelle espèce prédomine dans l'eau minérale ?

A pH=8,4, inférieur à pKa2, supérieur à pKa1, la
forme HCO3- aq prédomine.
On dose un volume V = 50,0 mL de cette eau par une solution d'acide chlorhydrique de concentration cA = 0,020 mol/L.
Quel est le pH de la solution titrante d'acide chlorhydrique.
Pour un acide fort, pH = -log cA = -log 0,020 = 1,7.
Ecrire l'équation de la réaction de dosage.
HCO3- aq +H3O+aq = CO2, H2O aq + H2O.
Déterminer l'équivalence E, retrouver la valeur de l'un des pKa.
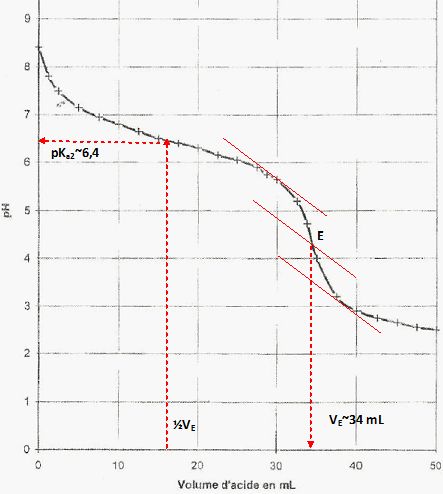
Calculer les concentration molaire C et massique Cm des ions hydrogénocarbonates.
A l'équivalence cA VE = V C ; C = cA VE / V=0,020 *34/50 =1,36 10-2~1,4 10-2 mol/L.
Cm = cA M(HCO3-)=1,36 10-2*61=0,83 g/L.
|
|
|