Silicium,
l'eau oxygénée, corrosion du fer.
Concours
technicien de l'industrie et des Mines
2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Le silicium.
le silicium est obtenu par réduction de la silice SiO2 par le carbone C. On obtient du silicium et du monoxyde de carbone.
Ecrire
l'équation bilan de la réaction.
2C(s) + SiO2(s) = Si(s)+ 2CO(g).
Montrer que le carbon est le réducteur.
SiO2
joue le rôle d'oxydant ( le degré d'oxydation du silicium passe de
+(IV) à zéro ) et C(s) celui de réducteur.
On
prépare annuellement en France 110 000 tonnes de silicium.
Calculer la quantité de matière de silicium. M(Si) = 28,1 g/mol.
n = 110 000 106/28,1 =3,9146 109 ~ 3,91 109 mol.
Quelles sont les masse de carbone et de silice utilisées ?
Quantité de matière de carbone : 2n ; masse de carbone : 2*3,9146 109 *12 ~9,4 1010 g ou 9,4 104 t.
Quantité de matière de silice : n ; M(SiO2) = 28,1+2*16 = 60,1 g/mol.
Masse de silice : 3,9146 109*60,1 ~2,4 1011 g ou 24,4 105 t.
L'eau oxygénée.
Elle
se décompose lentement en dioxygène et en eau et cette raction de
dismutation peut être accélérée en présence de chlorure de fer
(III).
Donner la composition d'un atome d'oxygène.
8 protons, 8 neutrons, 16 nucléons et 8 électrons.
Donner
la configuration électronique de l'atome d'oxygène et de l'atome
d'hydrogène. En déduire le nombre d'électrons de valence.
L'atome d'oxygène : 1s2 2p6, soit 6 électrons externes. L'atome d'hydrogène compte un seul électron.
Donner le schéma de Lewis de la molécule d'eau et sa géométrie en utilisant la théorie VSEPR.
Type AX2E2, 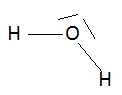 Ecrire l'équation bilan de la réaction de décomposition de l'eau oxygénée.
H2O2 ---> H2O +½O2.
On dispose d'une solution d'eau oxygénée de volume V = 100 mL et de concentration c = 6 10-3 mol/L.
A
l'instant initial t=0, on ajoute 20 mL d'une solution de chlorure de
fer (III). On dose ensuite régulièrement la quantité d'eau oxygénée
restante et on obtient les résultats suivants : | t(min) | 5 | 10 | 15 | 20 | | Quantité H2O2 restant( mol) | 4,6 10-4 | 3,7 10-4 | 2,9 10-4 | 2,3 10-4 |
|
| .
. |
|
|
Calculer la quantité de matière initiale d'eau oxygénée.
n0 = cV =6 10-3*0,100 = 6 10-4 mol.
Calculer les quantités de matière de dioxygène formées à t1 = 10 min et à t2 = 15 min.
A la date t1, (6-3,7)10-4 =2,3 10-4 mol d'eau oxygénée ont réagi ; il s'est formé n1=0,5*2,3 10-4 =1,15 10-4 mol de dioxygène.
A la date t2, (6-2,9)10-4 =3,1 10-4 mol d'eau oxygénée ont réagi ; il s'est formé n2=0,5*3,1 10-4 =1,55 10-4 mol de dioxygène.
Calculer la vitesse moyenne de formation du dioxygène ( en mol s-1) entre les dates t1 et t2.
(n2-n1) / (t2-t1) = 4,0 10-5 /(5*60)=1,3 10-7 mol s-1.
Quel est le rôle de la solution de fer (III).
Catalyseur.
|
.
|
|
Protection du fer contre la corrosion.
Ecrire les demi-équations électroniques qui se produisent sur l'électrode de magnésium et sur la cuve en fer.
Oxydation du magnésium Mg = Mg2++2e-.
Réduction des ions fer II : Fe2++2e-=Fe.
Compléter le schéma suivant en notant le sens de circulation des électrons, les pôles + et -, l'anode et lacathode.
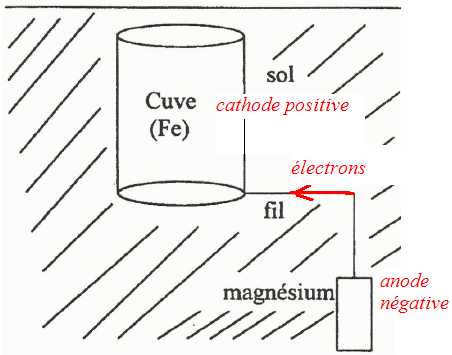
Expliquer pouquoi le magnésium est capable de protéger le fer.
Le magnésium, plus réducteur que le fer, joue le rôle d'anode sacrificielle ; il s'oxyde à la place du fer.
La masse de magnésium utilisée est m = 200 g. On admet que le courant de protection d'intensité I = 15,0 mA est constant.
Calculer ladurée théorique de la protection en secondes puis en années.
Quantité de matière de magnésium n = m / M(Mg) = 200 / 24,3 =8,23 mol ; quantité de matière d'électron : 2n = 16,46 mol.
Quantité d'électricité Q = 2n F = 16,46*96500 =1,59 106 C.
Dt = Q / I =1,59 106 / 0,015 =1,09 108 s ou 1,09 108 /(3600*24*365)=3,36 ans.
Quelle serait la masse de fer qui disparaîtrait pendant la même durée dans les mêmes conditions si la cuve n'était pas prootégée ?
Quantité de matière de fer : n ;masse de fer : n M(Fe) = 8,23*55,8= 459 g.
|
|
|