L'uranium :
l'atome, métallurgie; électrolyse solution NaCl ; dosage dioxyde de
soufre dans l'air ; polychlorure de vinylidène. Concours
technicien de l'industrie et des Mines
2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
L'uranium
atomique.
L'uranium est un élément qui possède plusieurs isotopes.
Définir
isotopes. Citer deux isotopes d'un autre élément. Dire pourquoi, d'un
point de vue purement chimique, il n'y a pas de différence de
comportement entre 2 isotopes .
Deux isotopes ne
se différencient que par leur nombre de neutrons. Ils ont le même
numéro atomique Z.
Exemple : 3517Cl et 3717Cl
; 126C et 146C.
La seule différence de comportement est liée à leur différence de masse
: ils ont donc les mêmes propriétés chimiques.
Donner la
composition de chacun des noyaux de l'uranium.
23592U : 92 protons et 235-92 =143 neutrons ; 23892U :
92 protons et 238-92 =146 neutrons.
La masse molaire de l'uranium
naturelle est 238,0289 g/mol. Masse
molaire de l'uranium 235 : 235,0439 g/mol ; de l'uranium 238 : 238,0508
g/mol.
En
déduire la teneur en uranium 235.
On note x la teneur en uranium
235 de l'uranium naturel :
235,0439 x +238,0508(1-x) =
238,0289 ; 3,0069 x =0,0219 ; x = 0,0073 (0,73 %).
L'uranium naturel existe sous
trois formes cristallines notées a, ß et g. La variété g est stable entre 775°C et 1130°C et cristallise
sous forme cubique centrée.
Représenter
cette maille. Combien la maille contient-elle d'atomes ?
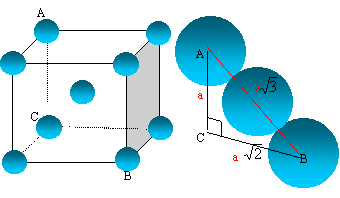
La
tangence s'effectue suivant la grande diagonale du cube :
a racine carrée (3) = 4 R
Les 8 atomes situés aux sommets
du cube sont communs à 8 mailles et comptent pour 1/8=0,125.
celui du centre, commun à une
seule maille, compte pour une unité.
nombre d'atomes d'uranium
appartenant à la maille : 8* 0,125 +1 = 2.
Le paramètre de maille est 350 pm.
En
déduire le rayon moyen de l'uranium dans cette structure supposée
compacte.
R = 350*3½/4 =152 pm.
Métallurgie
de l'uranium.
L'une des étapes est la réduction de UO 3.
3UO3(s) + 2NH3(g) = 3UO2(s) +N2(g)
+3H2O(g) (1).
Donner
les degrés d'oxydation de l'uanium dans UO2 et UO3.
Dans UO 2 : n.o(U) +2*(-2) = 0 ; n.o(U) = IV. Dans UO3 : n.o(U) +3*(-2) = 0 ; n.o(U) = VI.
Calculer DrH°(298K).
DrH° =3DfH°(UO2(s))+3DfH°(H2O(g))-2DfH°(NH3(g))-3DfH°(UO3(s)).
DrH°
=3*(-1085)+3(-241,8)-2(-46,19)-3(-1224)= -216 kJ/mol.
Pour
favoriser la formation de UO2(s),
a-t-on
intérêt à travailler à haute ou à basse température ? A-t-on intérêt à
travailler à pression élevée ? Justifier.
DrH° est négatif
: la réaction est exothermique et sera favorisée par un température peu
élevée.
Initialement il y a 2 moles de gaz, finalement il y a 4 moles de gaz :
la réaction est favorisée par une pression assez faible.
Calculer
DrS°(298K) en se
plaçant dans l'approximation d'Ellingham), qu'on rappellera, déterminer
DrG°(298K).
L'enthalpie
standard de
réaction et l'entropie standard DrS°
de la réaction ne dépendent pas de la température en dehors de tout
changement de phase.
DrS° =3S°(UO2(s))+3S°(H2O(g))+S°(N2(g))-2S°(NH3(g))-3S°(UO3(s)).
DrS° =3*77,8
+3*188,7+191,5-2*192,3-3*98,6=310,6 J K-1 mol-1.
DrG° =DrH°-TDrS° =-2,16 105
-298*310,6 =-3,09 105 J/mol.
On travaille à 900 K sous 1 bar. Calculer la
constante d'équilibre et conclure.
DrG° =-RT ln K ; ln K =
DrG° /(-RT) =3,09 105
/(8,314*900) =41,3 ; K = 8,6 1017.
La constante K étant grande, la réaction est totale.
|
| .
. |
|
|
Electrolyse
d'une solution de chlorure de sodium.
Les électrodes sont inattaquables. E°(Na+/Na) = -2,70 V ;
E°(H2O/H2) = 0,0 V ; E°(O2/H2O)
= 1,23 V ; E°(Cl2/Cl-) = 1,36 V.
Quels
produits peut-on obtenir aux électrodes au regard des
potentiels redox ?
On peut prévoir la réduction de l'eau en dihydrogène à la cathode et
l'oxydation de l'eau en dioxygène à l'anode.
On observe en réalité un dégagement de dihydrogène à la cathode
et un dégagement de dichlore à l'anode
Définir
les termes anode et cathode.
Anode : électrode où se produit une oxydation ; cathode : électrode où
se produit une réduction.
Coment
peut-on caractériser les produits formés ?
En présence d'une flamme le dihydrogène donne une petite détonation ;
le dichlore décolore une solution d'indigo.
Ecrire
l'équation de la réaction qui se produit à l'anode.
2Cl-= Cl2 + 2e-.
Comment justifier la
différence entre les prévisions théoriques et les observations
expérimentales ?
Le dégagtement du dioxygène ne se produit pas à l'anode du fait d'une
très forte surtension nécessaire à sa formation.
Cette électrolyse est réalisée industriellement pour fabriquer V = 1000
L de dichlore.
Quelle masse m de chlorure
de sodium en solution faut-il électrolyser ?
Vm = 25 L/mol. M(NaCl) = 23+35,5 = 58,5 g/mol.
Quantité de matière de dichlore : n = V / Vm = 1000/25 = 40
moles.
Quantité de matière d''ion chlorure 2n = 80 mol. Quantité de matière de
chlorure de sodium : 80 moles.
m = 2n M(NaCl) = 80*58,5 = 4,68 kg.
Calculer
l'intensité du courant qui a traversé le montage en 24 heures.
Quantité de matière d'électron : 2 n = 80 moles.
Quantité d'électricité : Q = 2nF = 80*96500 = 7,72 106 C.
I = Q / Dt = 7,72
106 /(24*3600)=89,4 A.
|
.
|
|
Dosage du dioxyde de soufre dans l'air.
On introduit dans une cuve 100 litres d'air. On y ajoute 100 mL d'eau ( SO2 est un gaz totalement soluble dans l'eau dans ces conditions ). On obtient VA = 100 mL d'une solution aqueuse (A) de dioxyde de soufre dissous à laquelle on ajoute un excès de diiode : V0 = 2,00 mL d'une solution de diiode I2 de concentration molaire c0 = 1,00 10-3 mol/L. La température est égale à 298 K. Le dioxyde de soufre réagit avec le diiode. E°1 ( SO42- / SO2) = 0,17 V ; E°2(I2/I-) = 0,62 V ; E°3(S4O62-/S2O32-) = 0,09 V.
Ecrire les demi-équations d'oxydoréduction. En déduire l'équation de la réaction.
SO2 +2H2O = SO42- +2e- +4H+ ; I2 + 2e- = 2I-.
SO2 +2H2O + I2 = SO42- +2I- +4H+.
Donner
l'expression de la constante d'équilibre en fonction des potentiels
standards des couples mis en jeu. La calculer et conclure.
K = [SO42-][I-]2[H+]4 /([SO2][I2]).
E1 = E°1 ( SO42- / SO2) +0,059/2 log([SO42-][H+]4/[SO2]) ; E2 =E°2(I2/I-)+0,059/2 log ([I2] /[I-]2).
A l'équilibre E1 =E2 ; E°2(I2/I-)-E°1 ( SO42- / SO2) =0,059/2 log([SO42-][H+]4/[SO2])-0,059/2 log ([I2] /[I-]2).
E°2(I2/I-)-E°1 ( SO42- / SO2) =0,059/2 log K ; log K = 2/0,059 (E°2(I2/I-)-E°1 ( SO42- / SO2)) = 2/0,059(0,62-0,17) =15,254 ; K = 1,80 1015.
K est très grande, la réaction est totale.
On dose le diiode en excès par une solution de thiosulfate de sodium de concentration c1 = 1,00 10-4 mol/L. Le volume à l'équivalence est Ve=34,8 mL.
Ecrire l'équation de la réaction de dosage.
2S2O32- + I2---> 2I-+S4O62-.
Donner l'expression du nombre de moles n1 de diiode dosé par le thiosulfate en fonction de c1 et Ve.
n1 = ½ c1Ve.
Donner l'expression du nombre de moles n2 de dioxyde de soufre qui a réagi en fonction de c0, V0 et n1.
Quantité de matière de diiode ayant réagi avec le dioxyde de soufre : c0V0-n1.
Quantité de matière de dioxyde de soufre : c0V0-n1.
En déduire la concentration cA de SO2 dans la solution A.
cA = (c0V0-½ c1Ve) / VA =(1,00 10-3*2,00-0,5*1,00 10-4 *34,8) / 100 =2,60 10-4 / 100 =2,60 10-6 mol/L.
Calculer la concentration c de SO2 dans l'air.
c = 2,6 10-4 / 100 = 2,6 10-6 mol/L= 2,6 10-3 mol m-3.
La valeur limite est de 410 µg( 0,410 mg ) de dioxyde de soufre par m3 d'air ( moyenne horaire à ne pas dépasser plus de 12 heures par an ). Conclure sur l'air prélevé ce jour -là.
M(SO2 ) =32+2*16=64 g/mol. M(SO2 ) c = 64 *2,6 10-3 =0,166 g m-3= 166 mg m-3. L'air contient trop de dioxyde de soufre.
|
|
Matière plastique, le polychlorure de vinylidène.
Certains
emballages alimentaires sont fabriqués à partir d'un polymères : le
polychlorure de vinylidène ( PVDC), obtenu par polymérisation du
chlorure de vinylidène ( VDC), un monomère de formule brute C2H2Cl2.
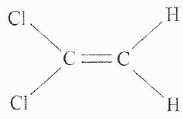
Donner le nom de ce monomère dans la nomenclature officielle. 1,1-dichloroéthène.
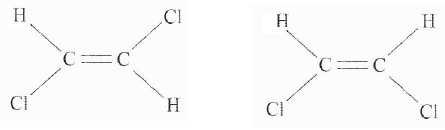
Donner
la formule d'une molécule isomère du chlorure de vinylidène présentant
l'isomérie Z-E. Représenter les deux stéréoisomères.
L'équation de polymérisation est schématisée ci-dessous :
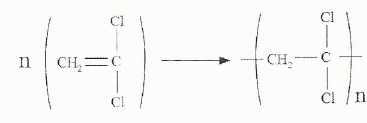
Calculer la masse molaire du monomère. M = 2*12+2+2*35,5 = 97 g/mol.
La masse molaire du polymère est 121250 g/mol. En déduire l'indice de polymérisation. n = 121250 /97 =1,25 103.
Pour
recycler le PVDC,il est possible de le dépolymériser afin de récupérer
le monomère. Celui-ci peut être détruit par combustion complète dans le
dioxygène à haute température en formant du dioxyde de carbone et du
chlorure d'hydrogène HCl. Ecrire l'équation de la combustion complète du VDC.
C2H2Cl2 + 2O2 ---> 2CO2 + 2HCl.
On effectue la combustion complète de m = 100 kg de VDC. Déterminer les masse de dioxyde de carbone et de chlorure d'hydrogène.
Quantité de matière de VDC : n = m /M = 100 000 /97 = 1030,93 mol
n(CO2) = n(HCl )= 2 n.
Masse de dioxyde de carbone : 2 n m(CO2) = 2*1030,93*44 = 90,7 kg ; m(HCl) = 2 n M(HCl) =2*1030,93*36,5 = 75 kg.
Quelles conséquences environnementales peuvent avoir les deux gaz produits lors de la combustion ?
Le dioxyde de carbone est un gaz à effet de serre et le chlorure d'hydrogène contribue aux pluies acides.
Pour
traiter les vapeurs acides de chlorure d'hydrogène, on utilise des
laveurs de gaz dont le principe consiste à piéger les vapeurs
acides en leur faisant traverser des films d'eau.
Ecrire l'équation de la réaction entre le chlorure d'hydrogène et l'eau.
HCl + H2O ---> H3O+ + Cl-.
Le pH mesuré dans un laveur dont la capacité est V= 3000 L est pH=4.
Calculer la quantité de matière d'ion oxonium présente dans le laveur.
10-pH V = 10-4*3000=0,3 mol.
On neutralise le solution obtenue par une solution commerciale d'hydroxyde de sodium. Ecrire l'équation de la neutralisation.
(H3O+ + Cl-) + (Na+ + HO-) ---> 2H2O + (Na+ +Cl-).
La solution commerciale est à 30,5 % en masse d'hydroxyde de sodium et a une masse volumique de 1,33 kg /L.
En déduire le volume de solution commerciale à utiliser.
Masse de 1 L : 1,33 kg ; masse d'hydroxyde de sodium : 1,33 *0,305 = 0,40565 kg = 405,65 g.
M(NaOH) = 40 g/mol ; quantité de matière d'hydroxyde de sodium : 405,65 / 40 = 10,14 mol dans 1 L.
Il
faut 0,3 mol d'hydroxyde de sodium pour neutraliser le contenu du
laveur : volume d'hydroxyde de sodium : 0,3 / 10,14 =0,0296 L ou 29,6
mL.
Un dépôt de chlorure de sodium solide NaCl dans le laveur
pourrait endommager la pompe permettant de vidanger le bac de lavage.
Al'issue de la neutralisation des 3000 L d'eau de lavage, les quantités
de matière en ions Na+ et Cl- sont égales à 0,3 mol chacune. Le produit de solubilité de NaCl est Ks = 39 à 25°C. Existe-t-il un risque de dépôt de sel ?
[Na+]=[Cl-]= 0,3 / 3000 =1,0 10-4 mol/L.
[Na+] [Cl-]= 1,0 10-8, valeur inférieure à Ks, le solide NaCl ne précipite pas.
|
|
|