Etude
thermodynamique de la réaction d'explosion du TNT.
Concours technicien de la police scientifique Lille 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
Le TNT a pour formule C7H5N3O6 explose sous l'action d'un choc important en libérant du carbone graphite, du monoxyde de carbone, du diazote et de l'eau.
Ecrire l'équation bilan de la réaction d'explosion d'une mole de TNT.
C7H5N3O6 (s) ---> 3,5 C(s) + 3,5 CO(g) + 1,5 N2(g) + 2,5 H2O(g).
Donner l'expression de l'enthalpie standard de la réaction ; la calculer et conclure.
DrH°=3,5 DfH°(CO(g))+2,5 DfH°(H2O(g))-DfH°(C7H5N3O6 (s)).
DrH°=3,5 *(-110,5) +2,5*(-241,8)+(-63,2)=-386,75 -604,5-63,2= -1054,45 ~ -1054 kJ/mol.
DrH° étant négatif, la réaction est exothermique.
Donner l'expression de l'entropie standard de la réaction ; la calculer et conclure.
DrS°=3,5 S°(C(s))+3,5 S°(CO(g))+1,5 S°(N2(g)+2,5 S°(H2O(g))-S°(C7H5N3O6 (s)).
DrS°=3,5*5,74+3,5 *197,5+2,5*188,7+1,5*191,6 -272=711,34 +411,75+287,4-272= 1138,5 J K-1 mol-1.
DrS° étant positif, le désordre augmente, le nombre final de molécules est très supérieur au nombre de moles initial.Ka On considère que l'enthelpie et l'entropie sont indépendants de la température.
Exprimer l'enthalpie libre standard DrG° ; la calculer à 298 K.
DrG°= DrH°-TDrS°.
DrG°= -1054 +298*1,1385 = -714,7 kJ/mol.
Calculer la constane thermodynamique K de la réaction à 298 K et conclure.
DrG°= -RT ln K ; ln K = 714,7 103/(8,314*298) =288,5 ; K = 1,9 10125.
K est très grand, la réaction est totale dans le sens direct.
Cette réaction provoque une augmentation de température et de pression. Expliquer.
La réaction étant exothermique, la température s'élève ; à partir d'une
mole de TNT, il se forme 7,5 moles de gaz : la pression va augmenter.
|
| .
. |
|
|
On
s'intéresse à l'explosion d'un bloc de 1 kg de TNT dans des conditions
isochores ( juste avant la déflagration ). La température du système
atteint 3200 K.
Calculer le volume initial de TNT. Densité du TNT d = 1,59.
Volume du TNT : V = masse / d = 1/1,59 = 0,63 L.
Calculer
la pression juste après l'explosion et conclure.
M(TNT) = 227 g/mol ; quantité de matière de TNT : n = 1000 /227 =4,4 mol.
Quantité de matière finale des gaz : 7,5 n = 7,5*4,4 =33,0 mol.
Les gaz étant asimilés à des gaz parfaits : P = nRT / V = 33,0 *8,32*3200 / (0,63 10-3) =1,4 109 Pa = 1,4 104 bar.
Le récipient contenant le TNT ne résiste pas à une telle pression.
|
.
|
|
Détection du TNT par chromatographie en phase gazeuse.
Expliquer brièvement le principe de la chromatographie en phase gazeuse.
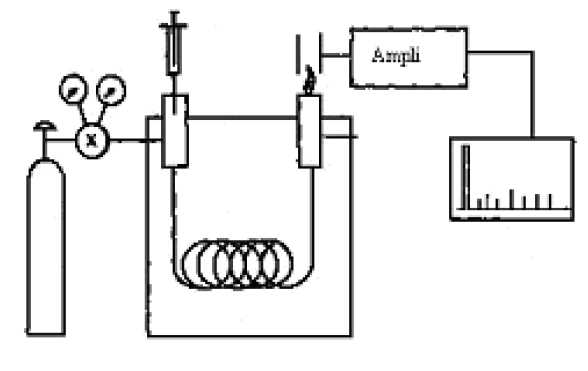
A droite, le gaz vecteur et l'injecteur ; au centre, la colonne placée dans une enceinte thermostatée ; à gauche, le détecteur.
Un
fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A
l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De
ce phénomène appelé rétention il résulte que les constituants du
mélange injecté se déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de
la colonne les uns après les autres et donc séparés.
Un
détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic.
En vous reportant au chromatogramme si-dessous, déterminer le temps mort tM et le temps de rétention du TNT.
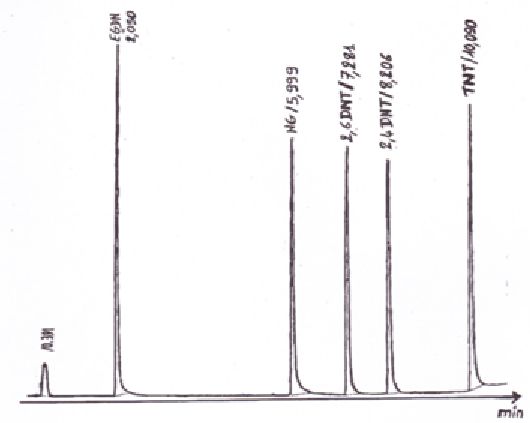
Dans
des conditions chromatographiques données, le "temps de rétention"
(temps au bout duquel un composé est élué de la colonne et détecté),
caractérise qualitativement une substance.
Pour le TNT, le temps de rétention vaut 10,090 min.
Le temps mort est le temps que met un soluté non retenu ( l(air par exemple) à sortir de la colonne.
|
|
|
Quels sont les principaux gaz vecteurs utilisables en chromatographie en phase gazeuxe ?
Hydrogène, hélium, azote.
Quelles sont les précautions à prendre vis-à-vis de ces gaz pour ne pas endommager la colonne ?
Le
gaz vecteur doit être pur, inerte (il ne doit pas réagir avec les
constituants de l'échantillon à séparer) et non miscible possible avec
la phase stationnaire.
Qu'est-ce qu'une injection en mode split ? Quelle est la différence avec une injection en mode splitless ?
Les injecteurs peuvent fonctionner suivant deux modes, avec ou sans division (encore appelés split ou splitless).
En
mode split, le gaz vecteur pénètre avec un grand débit dans la chambre
de vaporisation ; une vanne de fuite sépare le courant gazeux en deux
parties : seule la plus petite pénétre dans la colonne. Ce
mode est utilisé dans les colonnes capillaires à faible débit. Le mode
splitless est utilisé dans le cas d'échantillons très dilués.
Quels sont les paramètres qui influent sur le temps de rétention ?
C'est
en jouant sur la nature de l'éluant (et dans une moindre mesure sur la
nature du support) que l'on parvient à séparer les constituants d'un
mélange.
|
|
|

