Synthèse en chimie
organique : concours assistant d'ingénieur 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
| .
. |
|
|
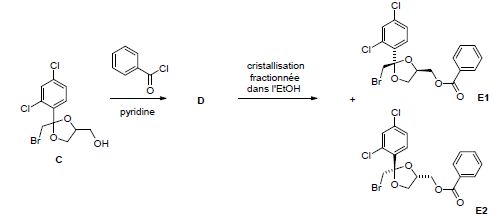
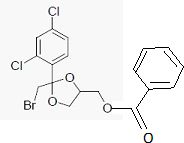
Donnez la formule semi-développée de D.
Proposez un autre réactif pour préparer D à partir de C.
Le chlorure d'acyle peut être remplacé par l'anhydride d'acide correspondante.
Quel est le but de l’étape de cristallisation ?
C'est un procédé chimique de purification par fractionnement : des solutés ont des solubilités différentes dans le même solvant.
E1 et E2 (répondre par oui ou par non) :
- Sont des diastéréoisomères : ( non , énantiomères)
- Ont un point de fusion identique : non.
- Migrent au même Rf sur CCM dans un solvant donné : non.
|
.

Proposez des réactifs pour préparer J à partir de I.
Hydrolyse basique du groupe amide.
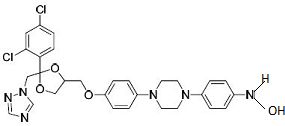
Donnez la formule semi-développée de K.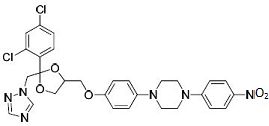
Donnez le nom de la réaction pour préparer K à partir de J. Alkylation d'Hofmann.
Pourquoi cette réaction peut-elle se produire sur le dérivé parachloronitrobenzène ?
Le cycle est fortement désactivé par le groupe nitro NO2.
Proposez des réactifs pour préparer L à partir de K.
Réduction du groupe nitro en amine primaire : fer en milieu acide.
Cette réaction, dans des conditions de réactivité douces, peut conduire à un autre dérivé ; dessinez sa structure. Donnez le nom de la fonction ainsi générée. Hydroxylamine.
Qui, des dérivés K et L est le plus polaire ?
Le groupe nitro est plus polaire que le groupe amine. K est plus polaire que L.
Représentez sur cette CCM, par des cercles, la migration des molécules K et L.
Le gel de silice est polaire : K aura plus d'affinité que L pour la
phase fixe. L élueara plus vite que K avec un solvant peu polaire.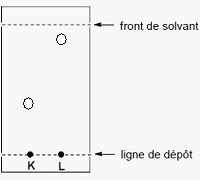
Si on décide d’analyser les 2 molécules K et L en HPLC et en travaillant en phase inverse, laquelle de ces 2 molécules aura le temps de rétention (Tr) le plus faible ? Justifiez.
La phase fixe est apolaire et retiendra plus facilement L que K. L aura un temps de rétention plus grand que K.
|
| |
|