Spectrophotométrie
de l'ultraviolet.
Une solution aqueuse de pemanganate de potassium ( c = 1,28 10
-4
mol/L) a une transmittance T= 0,5 à 525 nm si, on utilise une cuve de
10 mm de parcours optique.
Calculer
le coefficient d'absorption molaire du permanganate pour cette longueur
d'onde.
La relation fondamentale utilisée en spectrophotométrie est
présentée sous la forme :
A= log (I0/I) = elc ( A est l'
absorbance ou densité optique)
Cette loi est vérifiée lorsque la solution est de
concentration inférieure à : c < 0,1 mol.L
-1.
e (
L mol-1
cm-1) est une caractéristique de la molécule.
Plus
e sera grand, plus la solution absorbe.
l est l'épaisseur de
la
cuve (
cm) et
c
la concentration de la solution (
mol/L).
A = -log T =
elc = -log 0,5
=0,30 ;
e = -log T /
(lc) =-log 0,5 /(1*1,28 10
-4) =2,36 10
3 L mol
-1
cm
-1.
Si
on double la concentration, calculer l'absorbance et la transmittance
de la nouvelle solution.
Absorbance et concentration sont proportionnelles.
A' = 2A = 0,60 ; T' = 10
-A' = 10
-0,60 =0,25.
Suivi d'une
cinétique par conductimétrie.
Le 2-chloro-2-méthylpropane s'hydrolyse suivant :
(CH3)3CCl +2H2O ---> (CH3)3COH
+ H3O++Cl-.
On suppose la cinétique d'ordre 1, de constante de vitesse k. On note c
= [(CH3)3CCl] à
l'instant t et c0 = [(CH3)3CCl]0
à l'instant t=0.
Etablisser la
relation entre c, c0, k et t.
dc/dt = -kc ; dc / c = -kdt ; d (ln c )= -kdt ; ln c = -kt + constante.
A l'instant initial t=0 : ln c0 = constante ; ln c = -kt +
ln c0 ; ln (c / c0) = -kt.
Déduisez-en
y=ln((soo-s) / soo) = -kt où soo représente la
conductivité de la solution quand t tend vers l'infini.
s = lH3O+[H3O+]
+lCl-[Cl-]
; [H3O+]=[Cl-]
=c0-c ; s= ( lH3O++lCl-)(c0-c).
soo= ( lH3O++lCl-)c0 ; soo-s =( lH3O++lCl-) c ; (soo-s) / soo) =c / c0.
Par suite ln((soo-s) / soo) = -kt.
On place sur un agitateur magnétique un becher
contenant 80 mL d'un mélange eau - acétone et 20 mL de (CH3)3CCl
de concentration c0 = 0,1 mol/L dans l'acétone puis on y introduit la
cellule conductimétrique.
On enregistre s et les
valeurs de y en fonction du temps.
t(s)
|
0
|
60
|
80
|
100
|
120
|
y
|
0
|
-0,34
|
-0,66
|
-1,13
|
-1,33
|
Vérifier
graphiquement que la cinétique est d'ordre 1 et en déduire k.
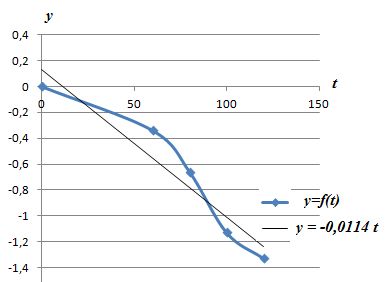
k = 0,0114 s-1.