Quelques aspects de la production
d'acétate d'éthyle,
concours inspecteur
CCRF 2013
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
L’acétate d’éthyle est un solvant utilisé dans de nombreuses
applications industrielles telles que la préparation de vernis, laques, encres, la fabrication de films
photographiques, la préparation d’arômes et de parfums.
L’acétate d’éthyle peut être obtenu par le procédé d’estérification de
Fischer entre l’acide acétique et l’éthanol selon l’équation de réaction :
CH3CH2OH + CH3COOH = CH3COOCH2CH3 + H2O.
Cette réaction est réalisée en phase liquide en présence d’un
catalyseur.
Etude théorique de la réaction d’estérification.
Etude thermodynamique.
Exprimer et calculer la valeur de l’enthalpie standard de la réaction à 298 K et commenter la valeur trouvée.
DrH° =DfH° (H2O) + DfH° (CH3COOCH2CH3) - DfH° (CH3COOH)- DfH° (
CH3CH2OH).
DrH° =-285,7 -477,5 +277,6 +484,3 =-1,3 kJ/mol.
Une valeur négative indique une réaction exothermique.
Exprimer et calculer la valeur de l’entropie standard de la réaction à 298 K.
DrS° =DfS° (H2O) + DfS° (CH3COOCH2CH3) - DfS° (CH3COOH)- DfS° (
CH3CH2OH).
DrS° =70 +257,7 -159,8-160,7 =7,2 J mol-1 K-1.Calculer la constante thermodynamique d’équilibre, K°, à 298 K. Conclure.
DrG° =DrH° -T DrS° =-1,3 103 -298*7,2 = -3,4456 103 J/mol.
DrG° =-RT ln K ; ln K = 3,4456 103 /(8,314*298)=1,39 ; K = 4,01.
K étant faible, la réaction est partielle et conduit à un équilibre.
Dans le cas d’un mélange initial constitué uniquement des réactifs introduits en proportion stoechiométrique, exprimer K° en fonction du taux de transformation des réactifs, puis calculer sa valeur à 298 °C.
K° = [eau] [ester]/ ([alcool][acide].
| avancement volumique (mol/L) | alcool | +acide acétique | = ester | +eau | | initial | 0 | c | c | 0 | 0 | | à l'équilibre | x | c-x | c-x | x | x |
On pose t = x/c ; K° = x2/(c-x)2 =t2/(1-t)2avec t = 2/3 = 0,667. K° =4.
Etude cinétique.
On
part maintenant d’un mélange initial constitué d’un excès d’éthanol par
rapport à l’acide acétique et de 0,1 équivalent en acide sulfurique. La
synthèse est réalisée à 100 °C, et la concentration en acide acétique
notée C est dosée au cours du temps pour donner le graphe suivant :
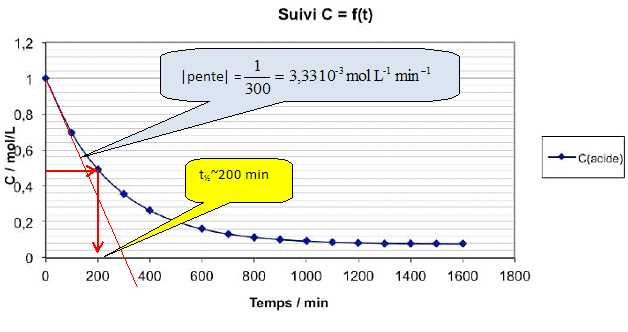
A l’aide de cette courbe, déterminer :
- le rendement de la réaction.
Le rendement est calculé à partir du réactif en défaut, l'acide éthanoïque.
(Cinitiale-Cfinale) / Cinitiale =(1-0,08) / 1 = 0,92 (92 %).
- la vitesse volumique initiale de la réaction d’estérification.
Il s'agit de la valeur absolue de la pente de la tangente à l'origine( voir graphe ci-dessus ).
- le temps de demi-réaction.
C'est la durée, notée t½, au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
Avancement
final : 0,92 ; tracer une horizontale passant par c = 0,46 mol/L ; à
l'intersection avec la courbe, tracer une verticale.
|
| .
. |
|
|
Expliquer et justifier comment l’allure du graphe est modifiée si le
seul paramètre qui change, par rapport aux conditions précédentes, est
le suivant :
- la température est abaissée à 50 °C.
L'équilibre est plus tardivement atteint, sa composition reste inchangée.
- le mélange initial est constitué des réactifs en proportions stoechiométriques et de 0,1 équivalent d’acide sulfurique.
La composition du mélange à l'équilibre est modifiée.
- la réaction est réalisée en présence d’un appareil de Dean-Stark et en présence d’un excès de toluène.
On élimine l'eau au fur et à mesure de sa formation : la réaction est alors totale.
- l’acide sulfurique n’est pas introduit dans le mélange initial.
En absence de catalyseur l'équilibre est ateint au bout d'un temps très long, sa composition est inchangée.
On rappelle la loi d’Arrhénius reliant la constante de vitesse à la température :
k(T)= Aexp (- Ea/(RT))
Avec Ea : énergie d’activation (en J.mol-1), R : constante des gaz parfait, T : température en Kelvin, A : facteur préexponentiel, indépendant de la température.
Retrouver la valeur de EA1.
On donne k1(328 K) =0,0874 SI ; k1(338 K) =0,147 SI ; EA1 =48,3 kJ/mol.
k1(338 K) / k1(328 K) = exp(-EA1 / (338R)) / exp(-EA1 / (328R))=exp(EA1 / R (1/328-1/338)).
ln(k1(338 K) / k1(328 K) =EA1 / R (1/328-1/338) =1,0846 10-5 EA1 ;
EA1 = ln(0,147 / 0,0874) /(1,0846 10-5) = 4,8 104 J mol-1.
|
.
|
|
Procédé de préparation de l’acétate d’éthyle.
On
s’intéresse dans cette partie au procédé industriel de synthèse
d’acétate d’éthyle. L’acide acétique est introduit dans un réacteur R
en présence d’un large excès d’éthanol. A l’équilibre, on considérera
que le mélange est composé uniquement d’éthanol, d’acétate d’éthyle et
d’eau. Ce mélange est alors envoyé dans une colonne de distillation D1, fonctionnant en discontinu.
Le
distillat obtenu en tête de colonne est envoyé dans un décanteur type
florentin, fonctionnant en continu. On obtient deux phases P1 et P2
dont les compositions sont indiquées en fractions massiques sous le
schéma. La phase riche en ester est alors dirigée vers une nouvelle
colonne de distillation D2, fonctionnant en continu. Le distillat obtenu en tête de colonne D2 a la même composition massique que celui en tête de colonne D1. On récupère alors le mélange restant en pied de colonne, qui est alors analysé puis stocké.
Le schéma de principe de l’installation est représenté ci-dessous :
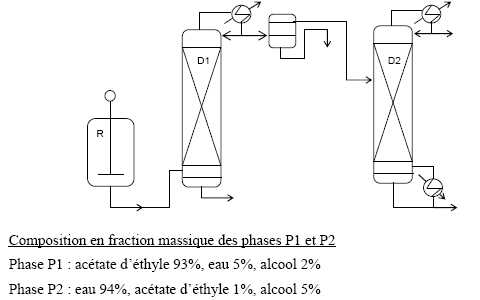
Pourquoi introduit-on un large excès d’éthanol dans le réacteur ?
CH3CH2OH + CH3COOH = CH3COOCH2CH3 + H2O.
Un excès d'éthanol déplace cet équilibre dans le sens direct, formation de l'ester.
Expliquer le fonctionnement d’une colonne à distiller, et rappeler les grandeurs caractéristiques importantes d’une colonne.
La distillation fractionnée consiste à vaporiser le mélange, puis en
réalisant une successions de condensation et de vaporisation on peut
récupérer l'un des constituants du mélange.
Caractéristiques d'une colonne à distiller :
La puissance de la colonne ou nombre de plateaux théoriques, zones dans
lesquelles liquide à l'ébullition et vapeur sont en équilibre.
Le débit, volume de vapeur traversant la colonne par seconde.
La hauteur équivalente à un plateau théorique.
Indiquer la composition (en fractions massiques) du mélange en tête de colonne D1.
Température d'ébullition en °C : eau : 100°C, éthanol : 78,3 ; acétate
d'éthyle : 77,15 ; azéotrope ternaire eau-éthanol-acétate d'éthyle :
70,2.
La
vapeur s'enricit en constituant le plus volatil en s'élevant dans la
colonne et en tête de colonne on récupère l'azéotrope ternaire.
Fractions massiques de cet azéotrope : eau : 9% ; éthanol : 8,5 % ; acétate d'éthyle : 82,5 %.
Indiquer la position relative des phases P1 et P2 dans le décanteur.
Dans le décanteur, la phase la plus dense, c'est à dire la phase P2 la plus riche en eau ( liquide le plus dense ), occupe la partie inférieure.
Sachant qu’on soutire 1200 kg de distillat en tête de la colonne D1, calculer la quantité de phase P1 et de phase P2 obtenue à la sortie du décanteur.
Dans 1200 kg d'azéotrope ternaire :
masse d'eau : 1200*0,09 =108 kg ; masse d'éthanol : 1200*0,085 =102 kg ; masse d'ester :1200*0,825 =990 kg.
On note x la masse de la phase P1et 1200-x la masse de la phase P2.
Masse d'eau contenue dans les deux phases : 108 = 0,05 x +(1200-x) *0,94 ; 108 = 1128-0,89 x ; x = 1146 kg.
La colonne D2 permet d’éliminer l’alcool du mélange que l’on veut stocker.
Calculer les masses initiales introduites en alcool, en eau et en ester dans la colonne D2, et la masse de distillat à soutirer pour éliminer totalement l’alcool du mélange introduit dans la colonne D2.
La phase P1 est introduite dans la colonne D2. Masse d'eau : 1146*0,05 =57,3 kg ; masse d'éthanol : 1146*0,02 =22,9 kg ; masse d'ester : 1146*0,93 =1165,8 kg.
Calculer
alors la composition du mélange acétate d’éthyle-eau stocké (on
indiquera les fractions massiques) et conclure sur l’intérêt de la
colonne D2.
|
Etude spectroscopique.
La pureté de l’ester synthétisé peut être vérifiée par différentes
méthodes spectroscopiques telles que la spectroscopie infra-rouge, la
spectroscopie de masse ou encore la spectroscopie par résonance
magnétique nucléaire.
Pour chacune de ces spectroscopies, les spectres de l’acide acétique, de l’éthanol et de l’ester sont donnés.
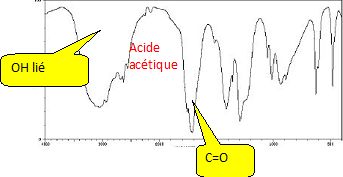
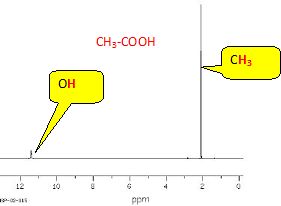
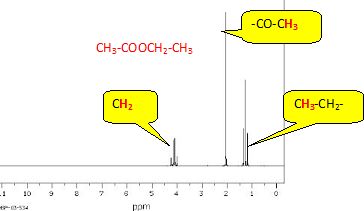
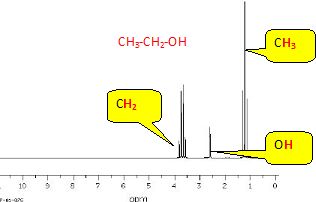
Attribuer à chaque molécule (acide acétique, éthanol et ester) ses trois spectres (IR, SM et RMN 1H). Justifier chaque choix.
Pour
chaque spectroscopie, expliquer quel(s) argument(s) permet(tent) au
chimiste de vérifier si le produit synthétisé est bien l’ester attendu
et s’il est pur ou non.
Spectre IR :
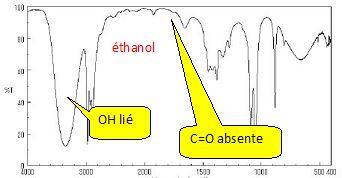 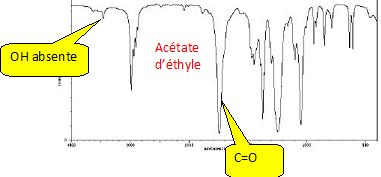
Spectre RMN 1H :
En spectrographie de masse on identifie les pics moléculaires à m/z =
46 pour l'éthanol, à m/z = 60 pour l'acide éthanoïque et à 88 pour
l'ester.
|
|
|