Synthèse
d'un ester à odeur de rhum.
Concours kiné Berck 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
On
souhaite synthétiser un ester E, dont l'odeur rappelle celle du rhum, à
partir d'un monoalcool saturé A et d'un acide carboxylique B.
Dans
un ballon de 100 mL, on introduit 9,2 mL d'alcool A pur, puis 32,0 mL
d'acide B pur et enfin, avec précaution, environ 1 mL d'acide
sulfurique concentré. On chauffe le mélange réactionnel, en utilisant
un montage à reflux, pendant 45 minutes. Le ballon est ensuite refroidi
puis son contenu est versé dans un becher contenant de la glace pilée.
Quand
la glace a fondu, le mélange obtenu est versé dans une ampoule à
décanter. On observe deux phases liquides que l'on sépare. La phase
organique est ensuite lavée et séchée. On isole l'ester E, on le pèse
et on trouve une masse mE = 9,8 g.
On donne le spectre RMN de l'alcool A de masse molaire 74 g/mol.
Déterminer la formule semi-développée de l'alcool A et préciser son nom.
Formule brute CnH2n+2O ; M = 12 n+2n+2+16 = 74 ; n = 4.
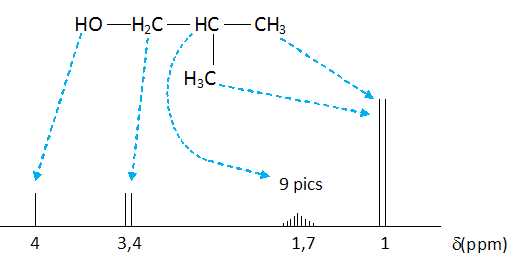
2-méthylpropan-1-ol.
On verse un volume V = 5,00 mL d'acide B pur dans de l'eau distillée pour préparer 500 mL d'une solution appelée S.
On prélève un volume VS =
10,0 mL de la solution S que l'on dose par une solution aqueuse
d'hydroxyde de sodium de concentration molaire en soluté apportée
c = 0,100 mol/L. Volume d'hydroxyde de sodium versée à
l'équivalence VE = 13,4 mL. Masse volumique de l'acide B : rB = 0,990 g/mL.
Déterminer la formule semi-développée de l'acide B et préciser son nom.
A l'équivalence [B]VS = VE c ; [B] = VE c / VS= 13,4*0,100 / 10,0 = 0,134 mol/L.
Soit 0,134/2 = 0,067 mol dans 500 mL ou dans 5 mL d'acide pur.
Masse d'acide pur : V rB =5*0,990 = 4,95 g.
M : mase molaire de l'acide carboxylique B ; 0,067 = 4,95 / M ; M = 74 g/mol.
Formule brute de l'acide B : Cx Hy-COOH ; M = 12x+y +12+32+1 = 74.
12x+y =29 ; soit x=2 et y = 5.
H3C-CH2-COOH, acide propanoïque.
|
|
|
Donner la formule semi-développée de l'ester et indiquer son nom.
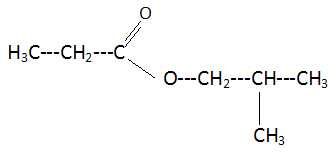
Propanoate de 2-méthylpropyle.
Calculer le rendement de la synthèse.
Masse volumique de l'alcool : 0,808 g/mL.
M(ester) =7*12+14+32 =130 g/mol.
Quantité de matière d'ester : 9,8 / 130 = 7,54 10-2 mol.
Quantités de matière initiales :
- d'alcool : 9,2 *0,808 / 74 =0,100 mol.
- d'acide B : 32,0 *0,990 / 74 = 0,428 mol.
L'alcool est en défaut. On peut former au mieux 0,100 mol d'ester.
Rendement : 7,54 10-2 /0,100 =0,754 ( 75,4 %).
|
.
|
|
Calculer la masse d'acide B qui n'a pas réagi.
7,54 10-2 mol d'acide a réagi avec 7,54 10-2 mol d'alcool.
Il reste donc : 0,428- 7,54 10-2=0,3526 mol
Masse d'acide restant : 0,3526 *74 = 26,1 g.
|
|
|