QCM
de chimie.
Concours kiné Ceerrf 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Déshydratation
d'un alcool.
La déshydratation du 2-méthylbutan-2-ol conduit à un mélange de deux
alcènes et de l'eau
A. C'est une
réaction d'élimination.
Vrai.
B.
Cette réaction a entraîné une modification de chaîne, avec diminution
du nombre de carbone. Faux
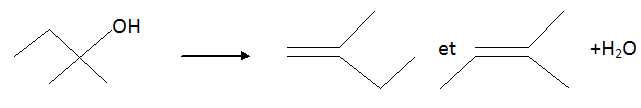
C.
Les deux alcènes sont formés en quantités égales. Faux.
D. Le
3-méthylbut-3-ène est le nom, dans la nomenclature officielle, de l'un
des alcènes formés. Faux.
Il se forme
du 2-méthylbut-1-ène ( minoritaire) et du 2-méthylbut-2-ène
(majoritaire ).
E.
Le but-2-ène est formé majoritairement. Faux.
F.
Aucune affirmation exacte.
Monoacide
faible.
On considère une solution S0 d'un monoacide noté
HA, de concentration c0. On prélève un volume V0
= 10,0 mL de cette solution que l'on verse dans une fiole jaugée de
volume V = 50 mL en complétant avec de l'eau distillée selon les règles
d'usage. La solution ainsi obtenue est notée S1.
On dose un volume V1 = 10,0 mL de la solution S1
par une solution de soude de concentration molaire cB
=1,0 10-3 mol/L. Le volume de soude versé à
l'équivalence est VE = 20 mL. L'acide HA
appartient au couple AH /A- de pKa
= 5,0 à 25°C.
Le pH de la solution S0 a pour valeur : 2 ; 2,5
; 3,0 ; 4,5 ; 5,0 ; aucune réponse exacte.
A l'équivalence : c1V1 =cBVE
; c1
=cBVE / V1
=1,0
10-3 *20 / 10,0 =2,0 10-3
mol/L.
c0 = 5 c1 = 1,0 10-2
mol/L.
pH = ½(pKa-log c) =0,5(5-log 10-2)
=0,5(5+2) = 3,5.
Cinétique
de réaction.
A.
Pour une transformation totale, le temps de demi-raction représente la
moitié de la durée totale de la transformation. Faux.
Le
temps de demi-réaction est la durée au bout de laquelle l'avancement
est égal à la moitié de l'avancement final.
B. Au
terme d'une durée égale à 4 fois son temps de demi-réaction, un système
chimique a atteint son état final. Vrai.
C. Agir sur un
facteur cinétique signifie diminuer la durée d'évolution d'un système
chimique. Vrai.
D. L'utilisation
d'un solvant polaire permet de diminuer la durée d'évolution d'un
système chimique. Faux.
E. Une
transformation chimique est d'autant plus rapide que la catalyse est
homogène. Faux.
F. Aucune
affirmation exacte.
Mono-acide
carboxylique.
On considère un monoacide carboxylique non cyclique et saturé. Sa masse
molaire est M = 102 g/mol.
Indiquer le nombre d'affirmations inexactes.
A.
Un des isomères de cet acide est l'acide 2-éthylpropanoïque. Faux.
CnH2nO2 ; M = 12 n+2n+32 =102
; 14 n = 70 ; n = 5.
Un isomère
possible est l'acide 2-méthylbutanoïque.
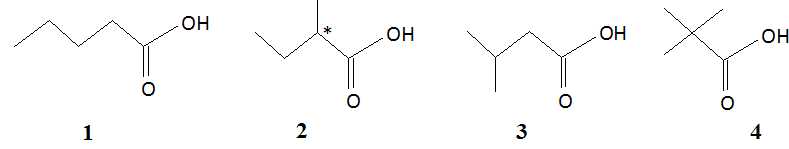
B.
Un des isomères de cet acide est une molécule chirale. Vrai.
C.
Un des isomères de cet acide a un spectre RMN constitué en tout de six
signaux. Faux.
D. Un des isomères
de cet acide a un spectre RMN constitué seulement de 2 signaux : deux
singulets. Vrai.
L'isomère n°4.
E.
Un des isomères de cet acide présente une diastéréoisomèrie. Faux.
|
|
Faux.
|
Pile à combustible.
Elle met en jeu la réaction entre le dioxygène et le dihydrogène. Les réactions aux électrodes ont pour équation :
à l'électrode 1 : ½O2 g + H2O +2e- --> 2HO-aq.
à l'électrode 2 : H2 g +2HO-aq --> 2H2O + 2e-.
La
tension de fonctionnement de la pile vaut 1,0 V pour une intensité I =
200 A. Les piles sont groupées en série de 30 pour former des modules.
1 F ~1 105 C mol-1.
A. La réaction entre le dioxygène et le dihydrogène nécessite toujours un milieu basique. Faux.
B.
L'électrode 2 est le pôle négatif de la pile car il s'y passe une réaction de réduction. Faux.
A l'électrode 2 le dihydrogène s'oxyde ; cette électrode est une anode et constitue le pôle négatif de la pile.
C. La tension aux bornes d'un module est 1,0 V. Faux
En série les tensions s'ajoutent : 30 V.
D. La masse de dihydrogène consommée par une de ces piles, par heure, est de 7,2 kg. Faux.
Q = It = 200*3600 = 7,2 105 C ; quantité de matière d'électron : n = 7,2 105 /105 = 7,2 mol.
Quantité de matière de dihydrogène : ½n = 3,6 mol ; masse de dihydrogène : 2*3,6 = 7,2 g.
E. La quantité de matière de dioxygène consommée par heure est 1,8 mole.
Vrai.
n(O2 ) = ½n(H2) = 0,5 *3,6 = 1,8 mol.
F. Aucune affirmation correcte.
|
.
|
|
Stéréoisomérie.
A. Une molécule possédant un seul carbone asymétrique fait partie d'une famille de deux énantiomères. Vrai.
Faux.B. L'acide 2-hydroxypropanoïque est une molécule chirale. Vrai.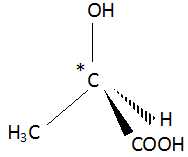
C. Tous les acides a-aminés possèdent un carbone asymétrique.
Faux.
D. Une molécule qui possède deux carbones asymétriques appartient forcément à un famille de 4 stéréoisomères. Faux.
Il peut y avoir un élément de symétrie.
Faux.E. Deux diastéréoisomères ont les mêmes propriétés physiques. Faux.
F. Aucune affirmation correcte.
Hydrolyse de l'aspartame.
L'hydrolyse conduit à la formation de l'acide aspartique et à un dérivé de la phénylalanine.
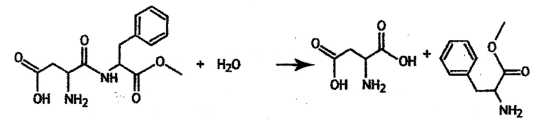
A. La molécule d'aspartame contient au moins un groupe carbonyle. Faux.
Cette
molécule contient une fonction ester, une fonction amide et une
fonction acide carboxylique, mais aucun groupe carbonyle d'un aldehyde
ou d'une cétone.
B. Au cours de cette réaction il y a coupure d'une seule liaison covalente et formation d'une seule liaison covalente. Faux.
Faux.Coupure de la liaison amide et formation de deux liaisons covalentes.
C.
La réaction peut être interptétée par un transfert d'électrons d'un
atome d'azote de l'aspartame vers l'un des atomes d'hydrogène de l'eau. Faux.
D. Le site donneur de doublets d'électrons de cette réaction est l'atome d'oxygène de l'eau. Vrai.
E. C'est une réaction d'addition. Faux.
F. Aucune affirmation exacte.
Peroxyde d'hydrogène.
Il intervient dans deux couples redox H2O2aq / H2O ; O2 g / H2O2 aq.
Il est donc usceptible de réagir avec lui même. La réaction est
considérée comme totale. Dans une solution de peroxyde d'hydrogène où
aucune réaction n'est apparente, on verse quelques gouttes d'une
solution de chlorure de fer (III) : on observe un dégagement gazeux de
dioxygène.
A. La réaction qui a lieu a pour équation : 2H2O2aq --> 2O2 g + 2H2 g. Faux.
Oxydation : H2O2aq --> O2 g+ 2e- +2H+aq.
Faux.Réduction : H2O2aq + 2e- +2H+aq -->2H2O.
2H2O2aq --> O2 g +2H2O.
B. Le pH ne varie pas au cours de la réaction. Vrai.
C. La solution de chlorure de fer (III) réalise une catalyse homogène. Vrai.
D. Le peroxyde d'hydrogène est un amphotère redox. Faux.
E. Lors de la réaction, le dioxygène est un oxydant. Faux.
Le peroxyde d'hydrogène joue à la fois le rôle de réducteur et d'oxydant. Le dioxygène est l'oxydant du couple O2 g / H2O2 aq.
F. Aucune affirmation exacte.
|
|
|
Le vin blanc contient du dioxyde de soufre SO2.
La législation prévoit un maximum de 210 mg/L de SO2
pour les vins blancs ou rosés. On prélève un volume V = 40 mL d'un vin
blanc. On ajoute quelques gouttes d'empois d'amidon et on acidifie le
milieu. On dose de dioxyde de soufre à l'aide d'une solution de diiode I2 de concentration molaire c1 = 1,0 10-2 mol/L. La couleur bleue persiste quand on a versé un volume V1 = 11,0 mL de diiode.
Couples redox : SO42-aq/ SO2 aq ; I2aq / I-aq.
A. Le vin blanc doit être acidifié avant d'effectuer le dosage car la réaction support du dosage consomme des ions oxonium. Faux.
Oxydation : SO2 aq +2H2O--> SO42-aq +4H+ + 2e-.
Réduction : I2aq + 2e---> 2I -aq.
Bilan : SO2 aq +2H2O + I2aq--> SO42-aq +4H+ +2I -aq.
B. L'empois d'amidon est un catalyseur de la réaction de dosage. Faux.
C'est l'indicateur de fin de réaction.
C. Le vin blanc est conforme à la législation. Vrai.
A l'équivalence : quantité de matière de diiode n = c1V1 =1,0 10-2 *11,0 =0,11 mmol.
Quantité de matière de SO2 : n =0,11 mmol dans 40 mL de vin soit 0,11 / 40 = 2,75 10-3 mol/L.
M(SO2) = 32 +32 = 64 g/mol ; 2,75 10-3 *64 =0,176 g/L ou 176 mg/L.
D. Le vin blanc n'est pas conforme à la législation. Faux.
E. Sans empois d'amidon le dosage aurait été très peu précis. Vrai.
E. Aucune affirmation correcte. Le dioxyde de carbone réagit avec une amine.
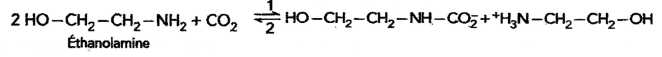
La réaction dans le sens 2 se fait dans des conditions particulières. Le dioxyde de carbone régénéré est compressé puis stocké.
A. L'éthanolamine comporte un seul site donneur d'électrons. Faux.
L'atome d'azote et l'atome d'oxygène sont donneurs d'électrons.
B. La réaction du dioxyde de carbone avec l'éthanolamine est une réaction sélective. Vrai.
C. Dans cette transformation, l'éthanolamine est un réactif chimiosélectif. Vrai.
D. La réaction dans le sens 1 est forcément limitée car la réaction inverse est possible. Faux.
La réaction dans le sens 2 n'est possible que dans des conditions bien particulières.
E. Le processus décrit, entre dans le cadre de la protection de l'environnement. Vrai.
F. Aucune affirmation correcte.
|
|
|