QCM
de chimie.
Concours kiné EFOM 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Oxydation du propan-2-ol par les ions permanganate en milieu acide.
On mélange un volume V = 7,7 mL de propan-2-ol pur et 0,050 mol d'ion permanganate MnO4- en milieu acide
L'équation de la raction est : 5C3H8O +2MnO4- +6H+ --> 5C3H6O +2Mn2++8H2O.
Densité par rapport à l'eau du propan-2-ol d = 0,78.
Aide aux calculs : 7,7 / 7,8 ~7,8 / 7,7 ~1 ; 7,8 *7,7 ~60.
A. L'alcool utilisé est primaire. Faux.
C'est un alcool secondaire.
B. La masse molaire du propan-2-ol est M = 60,0 g/mol . Vrai.
M = 12*3 +8+16 =60 g/mol.
C.
Le produit de l'oxydation est le propanal. Faux.
Le produit de l'oxydation est la propanone ou acétone.
D. Le mélange initial est tel que l'alcool est le réactif limitant. Vrai.
Quantités de matière initiales : n(alcool) =V d / M =7,7*0,78 / 60 =6/60 = 0,1 mol ;
0,1 mol d'alcool ragit avec 0,1 /2,5 = 0,04 mol d'ion permanganate ; ce dernier est en excès.
E.
La transformation est catalysée par les ions H+. Faux.
Les ions H+ sont l'un des réactifs.
Solution d'ion fer (II).
On souhaite préparer, à partir du sel de Mohr FeSO4, (NH4)2SO4, 6H2O, un volume Vsol = 50 mL d'une solution aqueuse de concentration molaire effecttive en ion Fe2+ égale à c=0,20 mol/L. Masse molaire du sel de Mohr M = 392,1 g/mol.
A. Il faut peser 3,921 mg de solide. Faux.
n(Fe2+) = Vsol c =0,050 *0,20 =0,01 mol.
Masse à peser : 0,01*392,1 = 3,921 g.
B. Il faut peser 3,921 g de solide. Vrai.
C. Il faut utiliser une pipette jaugée lors de cette préparation. Faux.
D. Il faut utiliser une fiole jaugée lors de cette préparation.Vrai.
E. Après dissolution complète, la concentration en ion sulfate est 0,20 mol/L. Faux.
2*0,20 = 0,40 mol/L.
(FeSO4, (NH4)2SO4, 6H2O)s --> Fe2+aq +2NH4+aq + 2SO42-aq.
Combustion.
La formule semi-développée de la 1-hydroxybutan-2-one est 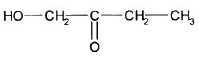
A. L'acide butanoïque et la 1-hydroxybutan-2-one sont isomères. Vrai.
CH3-CH2-CH2-COOH.
B. L'oxydation ménagée de la butanone permet d'obtenir l'acide butanoïque. Faux.
Une cétone ne subit pas d'oxydation ménagée.
La combustion complète d'une mole de 2-méthylpropane en présence d'un excès de dioxygène libère :
C. 3 moles de dioxyde de carbone Faux. C4H10 + 6,5O2 --> 4 CO2 + 5 H2O.
D. 5 moles d'eau. Vrai.
E. Le 2-méthylpropane ne compote que des liaisons simples. Vrai.
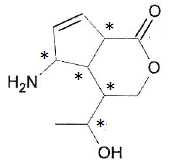
A. La représentation utilisée est une représentation topologique. Vrai.
B. La formule brute de la molécule est C10H15O3N. Vrai.
C. La molécule possède un groupe carbonyle. Faux.
La molécule possède un groupe ester cyclique.
D. La molécule possède un groupe hydroxyle. Vrai.
E. La molécule possède 5 atomes de carbone asymétriques. Vrai.
|
|
|
RMN du proton.
On réalise le spectre RMN du proton d'une molécule de formule brute C5H10O2.
Le
spectre fait apparaître 2 triplets et 2 singulets. Chacun des triplets
intègre pour 2 protons et chacun des singulets intègre pour 3 protons.
A. La molécule est l'acide pentanoïque. Faux.
B.
La molécule est l'éthanoate de propyle. Faux.
C. La molécule est le propanoate d'éthyle. Faux
D. La formule semi-développée de la molécule est : 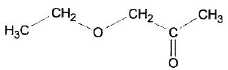 Faux. Faux.
E. La formule semi-développée de la molécule est :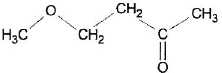 Vrai.
Vrai.
|
.
|
|
Spectrophotométrie.
En
vue de réaliser un suivi cinétique par spectrophotométrie, on mesure
l'absorbance A de diverse solutions aqueuses de diiode de
concentrations diverses.
| [I2] mol m-3 | 0,20 | 0,45 | 0,60 | 1,2 | | [I2] mol L-1 | 0,20 10-3 | 0,45 10-3 | 0,60 10-3 | 1,2 10-3 | | A | 0,2 | 0,45 | 0,6 | 1,2 | | k=A/[I2] en L mol-1. | 1,0 103 | 1,0 103 | 1,0 103 | 1,0 103 |
On fait réagir une solution aqueuse de peroxyde d'hydrogène H2O2 avec des ions iodure I-.
Le peroxyde d'hydrogène est en excès dans le mélange. Il se forme du
diiode qui est la seule espèce colorée du mélange. Après agitation
initiale, on place rapidement un échantillon du mélange réactionnel
dans le spectrophotomètre. La courbe A = f(t) est donnée ci-après. La
transformation est supposée totale.
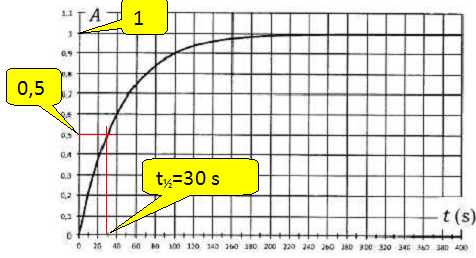
A. La loi de Beer-Lambert s'exprime ici par A = k [I2] avec k=1,0 10-3 L mol-1. Faux.
B. Les ions iodures subissent une réduction. Faux.
Oxydation 2I -aq --> I2 aq + 2e-.
C. Le temps de demi-réaction est environ 30 s. Vrai.
Durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
D. La concentration initiale des ions iodures était 1,0 mol m-3. Faux.
[I2]final = 1 mol m-3 ; [I -]initiale = 2 mol m-3 .
E. Le temps de demi-réaction serait plus court en chauffant le mélange. Vrai.
Titrage de l'acide benzoïque.
A 25°C, le pKa du couple de l'acide benzoïque C6H5-COOH /C6H5-COO- vaut 4,2. L'ion hydroxyde HO-
est une base forte en solution aqueuse. On réalise le titrage d'un
volume V =10,0 mL d'une solution aqueuse d'acide benzoïque par une
solution d'hydroxyde de sodium ( Na+ +HO-) de concentration molaire c = 1,0 10-2 mol/L. On donne la courbe de suivi-pHmétrique.
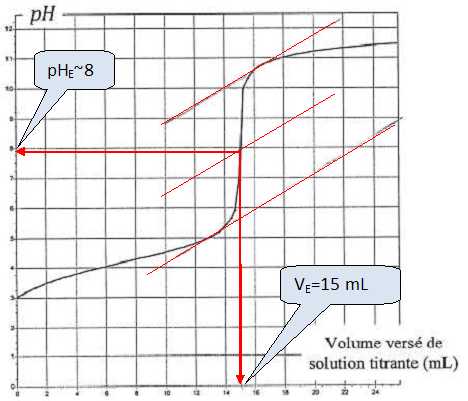
A. Un acide est une espèce capable de céder un ou plusieurs électrons. Faux.
Un acide est une espèce susceptible de céder un proton.
B. La solution titrante a un pH égal à 11,5. Faux.
pH=14 + log c = 14 + log(1,0 10-2) = 12.
C. A l'équivalence, le mélange a le même pH qu'une eau neutre à 25°C.
pHE ~8 (voir graphe).
D. L'ion benzoate prédomine devant son acide conjugué dans le mélange à l'équivalence. Vrai.
A pH > pKa, la base conjuguée prédomine.
E. La concentration molaire en soluté apporté de lasolution d'acide benzoïque vaut 1,5 10-2 mol/L. Vrai.
A l'équivalence [C6H5-COOH] V = c VE ; [C6H5-COOH] =VE c/V =15*1,0 10-2 / 10 =1,5 10-2 mol/L.
Mécanisme réactionnel.
Lors d'une étape d'un mécanisme réactionnel, les ions cyanure 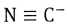 réagissent avec le méthanal H2C=O pour former NC-CH2-O-. réagissent avec le méthanal H2C=O pour former NC-CH2-O-.
A. Les ions cyanure sont des anions. Vrai.
B. L'atome de carbone du méthanal est un site donneur de doublet d'électrons. Faux.
C. Les liaisons multiples sont des sites donneurs de doublet d'électrons. Vrai.
D. Cette étape est une réaction de substitution. Faux.
Addition sur le carbone du carbonyle.
E. Lors de cette étape, l'atome de carbone de l'ion cyanure est le cite donneur de doublets d'électrons. Vrai.
|
|
|
Synthèse du méthanoate d'éthyle.
| Formule | Densité | Solubilité dans l'eau | Température d'ébullition °C | | acide méthanoïque | HCOOH | 1,22 | très élevée | 100,7 | | éthanol | CH3-CH2-OH | 0,79 | très élevée | 78,5 | | méthanoate d'éthyle | HCOOCH2-CH3 | 0,91 | très faible | 54,3 | | eau | H2O | 1,00 | xxxx | 100 |
La
réaction entre lacide méthanoïque et l'éthanol produit du méthanoate
d'éthyle et de l'eau selon une équation de réaction où tous les
coefficients stoechiométriques sont égaux à 1. Dans un ballon on
introduit 2,0 mol d'acide méthanoïque, 2,0 mol d'éthanol , un peu
d'acide sulfurique et quelques grains de pierre ponce. On porte à
ébullition le mélange réactionnel avec un montage à reflux. On réalise
par la suite un relargage puis une décantation. On obtient 0,8 mol
d'ester.
A. Dans ce montage le ballon doit ête surmonté d'un réfrigérant vertical. Vrai.
B. Le mélange initial est stoechiométrique. Vrai.
C. Une distillation fractionnée permet d'extraire l'ester du mélange. Vrai.
L'ester est l'espèce la plus volatil.
D. Lors de la décantation du distillat traité, la phase organique se place sous la phase aqueuse. Faux.
La phase organique est constituée de l'ester, moins dense que l'eau.
E. Le rendement de la synthèse est de 80 %. Faux.
rendement = avancement final / avancement maximal = 0,8 / 2 = 0,4 ( 40 %). 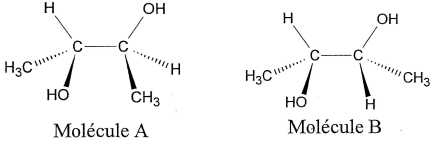
A. La molécule A possède 2 atomes de carbone asymétriques. Vrai.
B. La molécule A est chirale. Faux.
La molécule A possède un centre de symétrie.
C. La molécule B est chirale. Vrai.
Elle possède deux atomes de carbone asymétriques et aucun élément de symétrie.
D. A et B forment un couple d'énantiomères. Faux.
E. A et B forment un couple de diastéréoisomères. Vrai.
On réalise le titrage de la teneur en ion chlorure Cl- d'un volume V0 = 100,0 mL d'une eau minérale par une solution de nitrate d'argent ( Ag+ +NO3-)
de concentration molaire c = 1,00 mol/L. La réaction forme du chlorure
d'argent solide. Ce titrage est réalisé par un suivi conductimétrique.
On négligera l'effet de dilution. De plus on supposera les différentes
conductivités molaires ioniques constantes. L'évolution de la
conductivité s en fonction du volume V ajouté de la solution de nitrate d'argent est donnée.
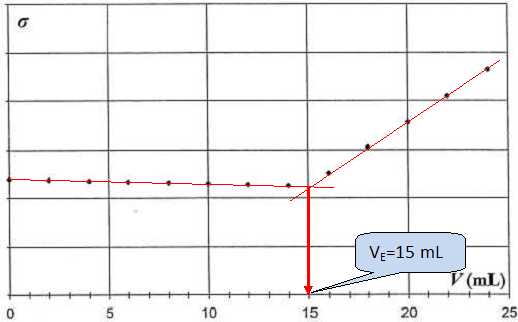
A. Avec certaines réactions de titrage, la conductivité peut diminuer après l'équivalence. Faux.
Après l'équivalence le réactif titrant est en excès ; on ajoute des ions à la solution et la conductivité augmente.
B. La conductivité s'exprime en siemens. Faux.
La conductance s'exprime en siemens, la conductivité s'exprime en S m-1.
C. La conductivité d'une solution de chlorure de sodium peu concentrée est proportionnelle à la concentration en soluté apporté. Vrai.
D.
Le suivi conductimétrique associé à la courbe proposée permet
d'affirmer que la conductivité molaire ionique des ions chlorure est
légèrement supérieure à celle des ions nitrate. Vrai.
Avant
l'équivalence, le nitrate d'argent est en défaut. Du point de vue de la
conductivité, tout revient à remplacer l'ion chlorure par l'ion nitrate
de conductivité molaire ionique moindre. La conductivité de la solution
décroît.
E. La concentration des ions chlorure dans l'eau minérale vaut 0,15 mol/L. Vrai.
A l'équivalence : [Cl-]V0 =VE c ; [Cl-]V0 =VE c / V0 =15*1,00 /100 =0,15 mol/L.
|
|
|