QCM : RMN du
proton,
spectre infrarouge, spectre UV-visible.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
RMN
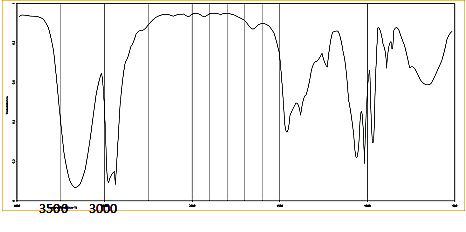
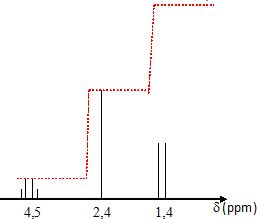
du proton d'une molécule de formule brute C4H7OCl.
La molécule possède un groupe carbonyle non situé à l'extrémité de la
chaîne et le spectre comporte 3 signaux :
un
quadruplet centré à 4,5 ppm ; un singulet centré à 2,4 ppm et un
doublet centré à 1,4 ppm. La courbe d'intégration est donnée en
pointillés rouges.
Cette
molécule peut être :
A) CH2Cl-CH2-CO-CH3
; B) CH3-CHCl-CO-CH3
Vrai ;
C) CH3Cl-CH2-CO-CH2
Cl ;
D) La courbe
d'intégration correspondant au doublet présente un palier de hauteur
triple de celle du palier correspondant au quadruplet. Vrai.
E) CH2Cl-CH2-CH2
-CHO
; F) Aucune des propositions
précédentes n'est vraie.
Le carbonyle n'étant pas à l'extrémité de
la chaine carbonée, la molécule est une cétone.
Le singulet à 2,4 ppm est
caractéristique du groupe méthyle -CH3 situé en a du carbonyle. ( ce groupe ne possède par
d'hyrogène proche voisin).
Le doublet à 1,4 ppm
correspond à un groupe méthyle : 3 protons couplés à un autre proton
porté par le carbone en position a.
Le quadruplet à 4,5 ppm
correspond à un unique proton couplé avec un groupe de trois protons
équivalents portés par le carbone en position a.
|
|
|
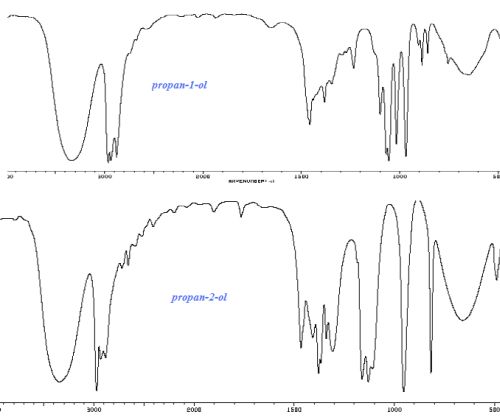
Quel est le
spectre RMN du proton du propan-1-ol CH3-CH2-CH2-OH
?
A) Spectre A ; B) Spectre B ; C) Spectre C ; D) Spectre D ; E) Aucun spectre ne convient.
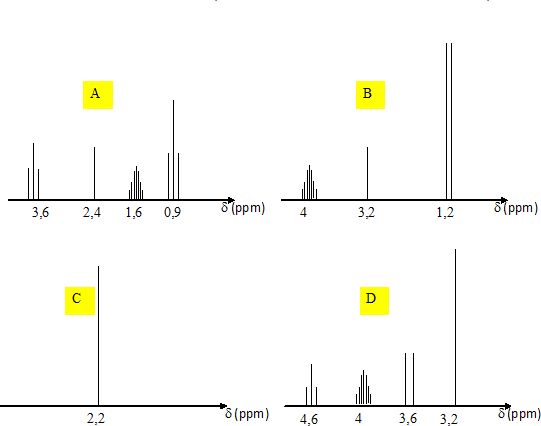
-CH2-OH : 2 protons équivalents couplés avec deux
autres protons équivalents ; le signal est un triplet centré vers 3,6
ppm.
CH3-CH2- : 3 protons équivalents couplés avec deux
autres protons équivalents ; le signal est un triplet centré vers 0,9
ppm.
-OH : singulet vers 2,4 ppm. Le proton du groupe hydroxyle ne se couple
pas avec les protons portés
par les atomes de carbone.
CH3-CH2-CH2 : 2 protons équivalents couplés avec 5
autres protons ; le signal est un multiplet centré vers 1,6 ppm.
Le spectre A convient.
|
.
Absorption
d'énergie par une molécule.
Le spectre IR du diméthylsulfoxyde fait apparaître une bande fine et
intense à 1100 cm-1.
On donne : c = 3 108 m/s ; 1 eV = 1,6 10-19
J ; h = 6,6 10-34 Js.
La fréquence de la
radiation absorbée vaut :
3,3 1013 Hz ( Vrai
) ; 3,3 1011 Hz ; 3,3 1015 Hz
; 2,7 105 kHz.
l = 1/1100 cm =
1/(1,1 105) m ; f = c / l
=3 108 *1,1 105 = 3,3 1013 Hz.
L'énergie absorbée
par la molécule vaut :
2,2 10-20 J ( Vrai
) ; 0,14 eV ( Vrai ) ; 2,2 10-18
J ; 1,4 meV.
E = h n = 6,6 10-34
*3,3 1013 =2,2 10-20 J ou 2,2 10-20
/(1,6 10-19) ~0,14 eV.
Spectre UV
visible du BBT.
L'indicateur coloré
étudié est le bleu
de bromothymol(BBT) dont les formes acide et basique seront notées
respectivement InH et In-.
Les graphes A= f(l) sont les
spectres d'absorption des formes acide et basique du BBT donnant
l'absorbance de la solution aqueuse en fonction de la longueur d'onde l.
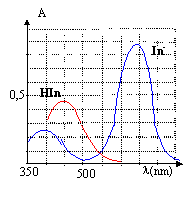 A) En milieu basique le BBT est
jaune. Faux.
A) En milieu basique le BBT est
jaune. Faux.
La forme In-
prédomine en milieu basique ; celle-ci présente un maximum d'absorption
vers 650 nm ( couleur jaune) ; la forme basique In-
a la couleur complémentaire du jaune, c'est à dire le bleu.
B) En milieu basique le BBT est bleu. Vrai.
C) En milieu
basique le BBT est vert. Faux.
En milieu neutre le BBT
est vert.
D) En milieu
basique le BBT est incolore. Faux.
E) En milieu
acide BBT est jaune. Vrai.
La forme InH prédomine en milieu acide ; celle-ci
présente un maximum d'absorption vers 450 nm ( couleur bleue) ; la
forme acide InH a la couleur
complémentaire du bleu, c'est à dire le jaune.
|
|
L'eau de Dakin.
On donne la loi de Beer-Lambert : A = Le(l) c.
e(l) coefficient d'exctinction
molaire ; c : concentration molaire volumique de l'espèce colorée ; L=
1 cm : longueur de solution traversée.
L'eau
de Dakin est un antiseptique- local contenant deux oxydants: les ions
permanganate MnO4– et hypochlorite ClO–. Sa
couleur est rose pâle. On dispose au laboratoire de solutions étalons
d'hypochlorite de sodium incolore et de permanganate de potassium
violette de
concentration c= 1,5.10-2 mol/L. Pour estimer
la concentration
molaire c' en ions colorés dans l'antiseptique, on réalise les spectres
suivants :
Solution
|
lmax
|
Absorbance
Amax
|
| Solution
étalon permanganate de
potassium diluée 100
fois c = 1,5 10-4 mol/L |
530 nm
|
0,35
|
Eau de
Dakin
|
530 nm
|
0,15
|
A) Le maximum d'absorption de l'eau
de Dakin est dans le vert. Vrai.
L'eau de Dakin est rose pâle ;
la couleur complémentaire est le vert ; l'eau de Dakin présente un
maximum d'absorption pour la couleur complémentaire du rose pâle.
B) emax = 23 L-1
mol cm-1.
emax =Amax /
(Lc) = 0,35 / (1*1,5 10-4) =2,3 103
L mol-1 cm-1.
C) emax = 2,3 105
L mol-1 m-1. Vrai.
emax =Amax /
(Lc) = 0,35 / (0,01*1,5 10-4) =2,3 105
L mol-1 m-1.
D) La concentration de
l'espèce colorée dans l'eau de Dakin est c' = 6,4 10-5 mol/L. Vrai.
c' = Amax/(Lemax) =0,15 / (0,01 *2,3 105)~6,4 10-5
mol/L.
|