QCM
de chimie.
Concours kiné St Michel 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Alcool, alcanes, température d'ébullition.
On considère les molécules organiques suivantes :
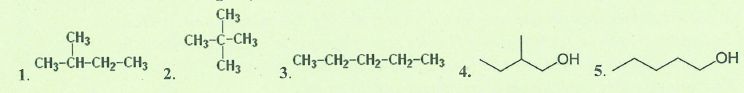
A. La molécule 5 est plus volatile que la molécule 3. Faux.
Dans un alcool l'existence de liaison hydrogène augmente la température d'ébullition par rapport à l'alcane correspondant.
B. La température d'ébullition de la molécule 5 est supérieure à celle de la molécule 4.
Vrai.
A nombre de carbone égal et pour une même fonction, la présence de ramifications diminue la température d'ébullition.
C.
La cohésion des alcanes à l'état liquide est essentiellement due à l'existence de liaisons hydrogène . Faux.
D. Le classement par ordre décroissant des températures d'ébullition des alcanes ci-dessus est 3 <1 <2. Faux.
La présence de ramifications, à nombre de carbone égal, diminue la température d'ébullition : 3 > 1 >2.
Evolution
d'un système chimique.
On considère la réaction de combustion du propane dans le dioxygène dont les produits sont l'eau et le dioxyde de carbone.
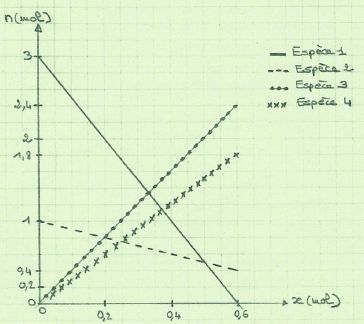 A. L'avancement maximal est égal à 0,4 mol. Faux.
A. L'avancement maximal est égal à 0,4 mol. Faux.
C3H8 +5O2
---> 3CO2 +4H2O.
A partir d'une mole de propane on consomme 5 mol de dioxygène; il se
forme 3 mol de dioxyde de carbone et 4 mol d'eau. L'espèce 1 est le
dioxygène, ce dernier est en défaut. L'espèce 2 est le propane.
L'avancement maximal est donc 3 / 5 = 0,6 mol ou bien 1-0,4 = 0,6 mol.
B. Le réactif limitant est le propane. Faux.
C. A la fin de la réaction, il a disparu 0,6 mol de l'espèce 2. Vrai.
D. L'espèce 3 est de l'eau.Vrai.
4*0,6 = 2,4 mol.
Influence des facteurs cinétiques.
A. La concentration étant un facteur cinétique, plus le temps passe et moins l'évolution du système est rapide. Vrai.
B. Au bout de t = 3 t½, les 7/8 du réactif limitant ont été consommé. Vrai.
A t½, la moitié du réactif limitant a été consommé ; à 2t½, les 3/4 du réactif limitant a été consommé ; à 3t½, 7/8 ou 0,875 ou 11-1/23 =7/8 du réactif limitant a été consommé.
C. L'évolution du système est d'autant plus rapide que la concentration des produits augmente. Faux.
D.
le catalyseur n'intervient pas dans l'équation bilan de la réaction
chimique, néanmoins, il permet d'obtenir une quantité de produits
supérieure en un temps plus rapide. Faux.
Un catalyseur augmente la vitesse de la réaction sans modifier la composition de l'état final.
Solutions acides.
On considère deux solutions d'acide éthanoïque dont la réaction avec l'eau est :
CH3COOH aq + H2O=CH3COO-aq + H3O+aq.
Une solution 1 pour laquelle V1 = 50 mL et pH1 = 6,0.
Une solution 2 pour laquelle V2 = 150 mL et pH2 = 3,0.
L'ajout de 10 mL d'eau à la solution 2 conduit à une solution de pH=3,03.
pKa( CH3COOH aq / CH3COO-aq) = 4,75.
A. Dans une
solution 1, la concentration en ion hydroxyde est égale à 10-8 mol/L. Vrai.
[HO-aq]=10-14 / [ H3O+aq] = 10-14 / 10-6 = 10-8 mol/L.
B.
La solution 2 peut être considérée comme une solution tampon. Faux.
Le pH d'une solution tampon renfermant ce couple acide / base serait égal au pKa soit 4,75.
C. L'acide éthanoïque est un acide faible. Vrai.
D. Lorsque l'on ajoute 450 mL d'eau à la solution 1 celle-ci devient neutre. Vrai.
En diluant suffisamment une solution d'acide faible de pH=6, on tend vers une solution de pH = 7.
|
|
Faux.
|
Spectroscopie IR et RMN.
A.
Le spectre RMN de la molécule de 2-méthylbutan-2-ol présente 4 signaux
correspondant aux 4 groupes de protons équivalents de la molécule. Vrai.
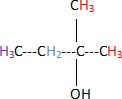
B. Pour distinguer le 2-méthylbutan-2-ol du pentan-3-ol, il faut utiliser la spectroscopie IR. Faux.
.
C. Pour un spectre IR, l'ordonnée représente l'absorbance, grandeur sans unité. Faux.
La transmittance en pourcentage.
D. Dans un spectre RMN, la multiplicité d'un signal est égale au nombre de protons équivalents auquel on ajoute 1. Faux.
Multiplicité : nombre de protons voisins augmenté de un.
|
.
|
|
RMN.
A. Le spectre RMN de la molécule de méthanol ne présente qu'un triplet. Faux.
CH3-OH : le spectre RMN présente deux singulets.
B. Deux énantiomères présentent le même spectre RMN. Vrai.
C. Dans un spectre RMN le signal est repéré par sa longueur d'onde.
Faux.
Chaque signal est repèré par son déplacement chimique en ppm.
D. Le spectre RMN du propane présente 2 signaux, intégrant l'un pour 6 protons, l'autre pour 2. Vrai.
CH3--CH2--CH3.
Donneur, accepteur d'électrons.
Electronégativité : H : 2,2 ; Li : 1,0 ; C : 2,5 ; N : 3,0 ; O : 3,4 ; Cl : 3,2 ; Mg : 1,31.
A. Dans le chlorométhane la liaison chlore-carbone est polarisée. Le carbone est alors un site accepteur d'électrons. Vrai.
B. Plus un atome est électronégatif, plus il est apte à porter des charges partielles négatives. Vrai.
C. Une liaison carbone-chlore est plus polarisée qu'une liaison magnésium-chlore. Faux.
Le chlorure de magnésium est un solide ionique.
D. Un atome de carbone lié à un atome de magnésium est un site donneur d'électrons. Vrai.
|
|
|
Relations d'isomérie.
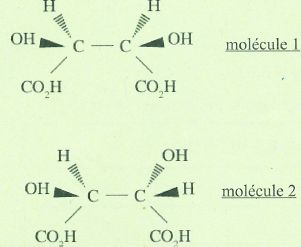
A. La molécule 1 n'est pas chirale. Vrai.
La molécule 1 possède 2 atomes de carbone asymétrique mais également un plan de symétrie.
B. Un mélange équimolaire des molécules 1 et 2 est un mélange racémique. Faux.
C. Les molécules 1 et 2 ont des propriétés chimiques et des caractéristiques physiques différentes. Vrai.
Ce sont des diastéréoisomères.
D. Les molécules 1 et 2 sont des diastéréoisomères. Vrai.
|
|
|