Le monoxyde de
carbone: structure, diagramme d'Ellingham. Bts chimiste 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Nous
nous intéressons à l’une des transformations se déroulant dans le pot
catalytique : l’oxydation du monoxyde de carbone en dioxyde de carbone.
Structure
du monoxyde de carbone.
Donner la configuration électronique de l'atome d'oxygène. Préciser les
électrons de coeur et les électrons de valence.
1s2
2s2 2p4 ; 1s2 : électrons de
coeur ; 2s2
2p4 : électrons de valence.
Donner
la configuration électronique de l'atome de carbone. Préciser les
électrons de coeur et les électrons de valence.
1s2
2s2 2p2 ; 1s2 : électrons de
coeur ; 2s2
2p2 : électrons de valence.
Proposer
un schéma de Lewis de la molécule de monoxyde de carbone.
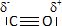 Donner
la représentation tridimensionnelle conventionnelle correspondant à une
orbitale atomique 2s.
Donner
la représentation tridimensionnelle conventionnelle correspondant à une
orbitale atomique 2s.
L'orbitale s est sphérique.
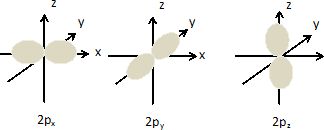
Combien existe-t-il d'orbitales atomiques 2p ? Donner les
représentations tridimensionnelles conventionnelles de ces orbitales
atomiques.
Il existe trois orbitales
atomiques 2p.
Pour obtenir une description approchée d’une molécule en chimie, on
limite l'étude à la fonction d'onde électronique de la molécule et on
utilise les orbitales moléculaires que l'on exprime par la théorie
C.L.O.A. appelée aussi L.C.A.O.
Que signifie ce sigle C.L.O.A. (ou L.C.A.O.) ?
Combinaisons linéaires
d'orbitales atomiques.
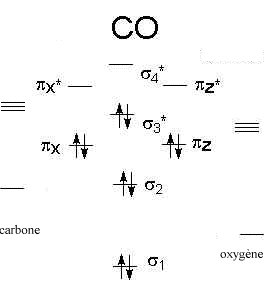
Compléter ce
diagramme d’orbitales moléculaires à l’aide des électrons de valence
des atomes de la molécule de monoxyde de carbone.
 La
molécule de monoxyde de carbone est-elle paramagnétique ou
diamagnétique ? Justifier.
La
molécule de monoxyde de carbone est-elle paramagnétique ou
diamagnétique ? Justifier.
Tous les électrons
sont appariés : la molécule CO est diamagnétique.
|
| .
. |
|
|
Intoxication au monoxyde de carbone .
Le dioxygène est faiblement soluble dans le sang. Le stockage et le
transport du dioxygène dans le corps sont assurés par deux protéines,
la myoglobine (notée Mb) et l'hémoglobine (notée Hb).
Le monoxyde de carbone peut se lier à l'ion fer II de l'hémoglobine et
peut prendre la place du dioxygène pour former la carboxyhémoglobine
HbCO, ce que l'on modélise par la réaction d'équation :
HbO2(aq) + CO(g) = HbCO(aq) + O2(g). (1)
Justifier que le monoxyde de carbone puisse se lier à l'ion fer II de
l'hémoglobine.
L'interaction
métal / ligand est du type acide de Lewis / base de Lewis. Le monoxyde
de carbone, molécule porteuse de doublets d'électrons libres est une
base de Lewis.
Pour traiter l'intoxication au
monoxyde de carbone, on fait respirer au patient intoxiqué du dioxygène
dans un caisson hyperbare. Justifier cette méthode.
En présence d'excès de
dioxygène, l'équilibre (1) est déplacé dans le sens indirect.
Diagramme
d’Ellingham de l’élément carbone.
On s’intéresse à présent au diagramme d’Ellingham de l’élément carbone.
Le carbone est considéré sous forme graphite (solide) ; le dioxygène,
le monoxyde de carbone et le dioxyde de carbone sont sous forme
gazeuse. Les températures sont comprises entre 500 K et 2000 K.
Soient les trois réactions d’oxydation suivantes mettant en jeu une
mole de dioxygène :
(1) Oxydation du carbone graphite en dioxyde de carbone gazeux ;
(2) Oxydation du carbone graphite en monoxyde de carbone gazeux ;
(3) Oxydation du monoxyde de carbone gazeux en dioxyde de carbone
gazeux.
Écrire les équations de ces trois réactions.
C(s) + O2(g)
=CO2(g) (1).
2C(s) + O2(g)
=2CO(g) (2).
2CO(g) + O2(g) =2CO2(g)
(3).
Calculer, pour la réaction (2),
l’enthalpie standard de réaction et l’entropie standard de réaction à
298 K.
DrH02=2
DH0(CO)-2
DH0(C)-DH0(O2)=
2(-110,5)= -221 kJ mol-1.
DrS02=2
S0(CO)-2 S0(C)-S0(O2)=
2*197,7-2*5,7-205,2= 178,8 JK-1 mol-1.
Rappeler en quoi consiste
l’approximation d’Ellingham.
L'entropie DrS° et l'enthalpie DrH° étant supposées
indépendantes de la température, les courbes d'équation DrG°(T) = DrH° - T DrS° sont des segments de droites. Les
ruptures de pente correspondent à des changements d'états physiques.
Donner l’expression de
l’enthalpie libre standard de la réaction (2).
DrG0=DrH0-TDrS0 = -221 -0,1788 T.
Les enthalpies libres
standard des réactions (1) et (3), exprimées en kJ.mol-1,
sont données respectivement par :
Dr°G1
(T) = -394 – 3,0110-3 T
DrG°3
(T) = -566 + 1,73 10-1 T.
Attribuer à chaque droite du diagramme la réaction correspondante.
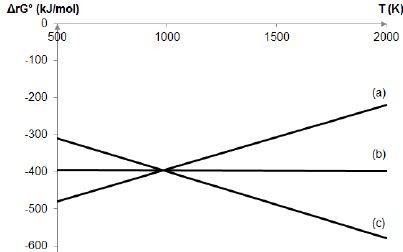
(b) correspond à(1) ; (c)
correspond à (2) ; (a) correspond à (3).
En
étudiant les positions relatives des différents tracés, justifier la
simplification proposée du diagramme d’Ellingham du carbone pour une
température inférieure à 980 K.
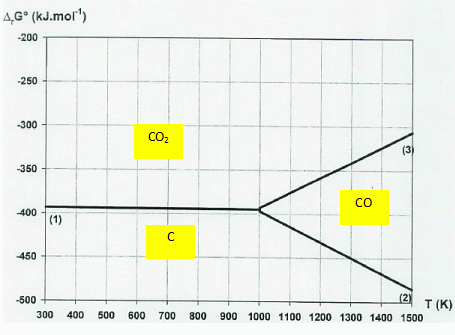
A une température
comprise entre 300 K et 1000 K, CO(g) ne prédomine
pas.
|
.
|
|
On
considère la réaction de réduction de l’oxyde de nickel (II) par le
carbone selon l’équation :
(4) NiO(s) + C(s) = Ni(s) + CO(g) Dr°G (T) = 129,3 – 0,183 T
(en kJ.mol-1)
En justifiant la réponse, préciser l’influence sur cet équilibre :
- d’une variation de la température à pression constante.
L'enthalpie standard est positive (
+129,3) : la réaction est endothermique. Une élévation de température à
pression constante déplace l'équilibre dans le sens direct.
- d’une variation de la pression totale à température constante.
Une augmentation de
pression à température constante déplace l'équilibre dans le sens
indirect, diminution du nombre de molécules gazeuses.
Industriellement la réduction du nickel s’effectue à 1000 °C.
Déterminer la valeur de la constante d’équilibre notée K de la réaction
(4). Conclure.
Dr°G
(1000) =129,3 -0,183*1000 = -53,7 kJ mol-1 = -5,37 104
J mol-1.
Dr°G (1000) = -RT ln K ; ln K = 5,37 104
/(8,314*1000)=6,46 ; K ~6,4 102.
K est grand, la réaction
est totale.
Quels avantages apporte le carbone en tant que réducteur ?
Le carbone joue un triple
rôle :
celui de réducteur ;
celui de
combustible pour fondre le minerai ;
celui de support poreux de la charge en minerai à travers duquel
s'échappe les gaz issus de la réduction.
|
|