Pouvoir
calorifique d'un combustible de substitution. Bts chimiste 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Préparation de l’échantillon.
Le combustible doit être pressé sous forme de pastilles. Lorsqu’il est
relativement mou (cas des textiles), on le rend cassant au contact du
diazote liquide avant de le broyer et de l’introduire dans la
pastilleuse. La fiche de sécurité d’utilisation du diazote liquide préconise le port
de gants cryogéniques, d’un écran facial et des locaux de stockage
ventilés afin d’éviter une anoxie (diminution de la quantité de
dioxygène dans les tissus causée par la diminution du taux de dioxygène
dans l’air inspiré).
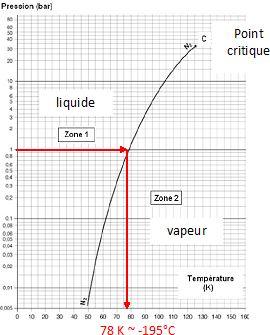
On donne la courbe associée à l’équilibre
liquide-vapeur du diazote. Préciser l’état physique du diazote dans les
zones 1 et 2. Comment nomme-t-on le point C, limite supérieure de cette courbe ?
Déterminer graphiquement la température, en kelvin, de l’équilibre
liquide-vapeur du diazote sous une pression de 1,00 bar ; exprimer
cette température en degré celsius afin de justifier l’utilisation de
gants cryogéniques lors de la manipulation de diazote liquide.
Déterminer la quantité de matière contenue dans un volume V = 1,00
L de diazote liquide sous une pression de 1,00 bar. rL N2 =0,803 kg/L.
Masse de diazote : 803 g ; quantité de matière n = 803 / 28=28,68 ~28,7 mol.
Déterminer le volume de gaz (supposé parfait) produit lors du
passage de 1,00 L de diazote liquide à l’état gazeux à la température
de l’équilibre liquide-vapeur sous une pression de 1,00 bar.
V = nRT / P = 28,68*8,314*78 / 105 =0,186 m3.
Déterminer la valeur de ce volume ramené dans les conditions de
température et de pression du local (1,00 bar ; 20 °C). Justifier la
nécessité de ventiler le local.
V = 28,68 *8,314*298 / 105=0,711 m3.
Ce volume est important par rapport au volume du local : une ventilation est nécessaire.
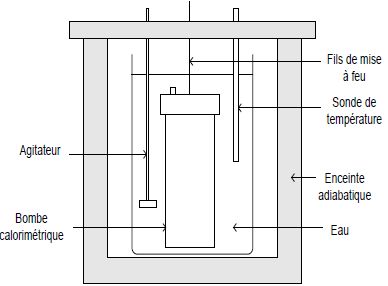
Mesure du pouvoir calorifique d’un combustible.
La pastille de combustible de masse m est placée à l’intérieur d’une
bombe calorimétrique de capacité thermique C dans laquelle est
introduit du dioxygène sous pression (30 bars) ; un système de mise à
feu complète ce dispositif. L’ensemble est introduit dans un seau
contenant une masse d’eau connue me. Le tout est disposé dans une enceinte adiabatique. Après la combustion, la mesure de l’élévation de température Dq de l’eau, lorsque l’équilibre thermique est atteint, permet de déterminer le pouvoir calorifique P du combustible utilisé.
|
| .
. |
|
|
Le technicien chimiste réalise ainsi une mesure avec une
pastille d’acide benzoïque de pouvoir calorifique connu puis avec une
pastille de combustible textile :
Nature du combustible
|
|
Acide benzoïque
|
Textile
|
Masse de la pastille (g)
|
m
|
1,03
|
1,12
|
Masse d'eau (kg)
|
me
|
1,978
|
2,035
|
Elévation de température (°C)
|
Dq
|
2,85
|
2,05
|
Que signifie le terme « adiabatique » ?
Les échanges de chaleur entre le système et le milieu extérieur sont nuls.
Établir la relation suivante donnant l’expression littérale de la capacité thermique C de la bombe calorimétrique : C = m P/Dq -me ce.
Energie cédée par le combustible : Q = -mP; énergie gagnée par l'eau : me ceDq.
Energie gagnée par la bombe calorimétrique CDq.
Système adiabatique : -mP +me ceDq +CDq= 0 ; C = m P/Dq -me ce.
À
l’aide des mesures effectuées avec l’acide benzoïque, déterminer la
valeur numérique de la capacité thermique de la bombe calorimétrique. Pacide benzoïque = 26,5 MJ.kg-1.
C = 1,03 10-3 *2,65 107 / 2,85 -1,978*4,18 103 =1,31 103 J K -1.
En déduire le pouvoir calorifique du combustible textile Ptextile.
Ptextile=(C + me ce)Dq / m = (1,31 103 + 2,035*4,18 103)*2,05 / (1,12 10-3)=1,80 107 J.kg-1.
Quels facteurs expérimentaux n’ont pas été pris en compte dans cette étude ?
Le système n'est pas complètement adiabatique.
Le dioxygène en excès et les produits issus de la combustion sont portès à température élevée.
|
.
|
|
Traitement statistique.
Dans les mêmes conditions, le technicien effectue au total pour ce
combustible huit mesures dont les résultats sont reportés ci-dessous :
Essai
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
Ptextile ( MJ kg-1)
|
18,0
|
17,9
|
18,2
|
18,2
|
17,9
|
17,9
|
18,0
|
17,8
|
Donner la meilleure estimation du pouvoir calorifique du combustible.
Moyenne : ( 18,0 + 17,9 +18,2 +18,2 +17,9 +17,9 +18,0 +17,8) / 8 =17,99 ~18,0 MJ kg-1.
À l’aide de la calculatrice, calculer l’écart-type s pour cette série de huit mesures.
s = 0,146.
En utilisant la méthode de Student, déterminer l’intervalle dans lequel
la valeur du pouvoir calorifique du combustible se trouve avec un
niveau de
confiance de 95%.
x = xmoy ± 2,37 s / n½ =18,0 ±2,37*0,146 / 8½ =18,0 ±0,12 ~(18,0 ±0,2) MJ kg-1.
|
|