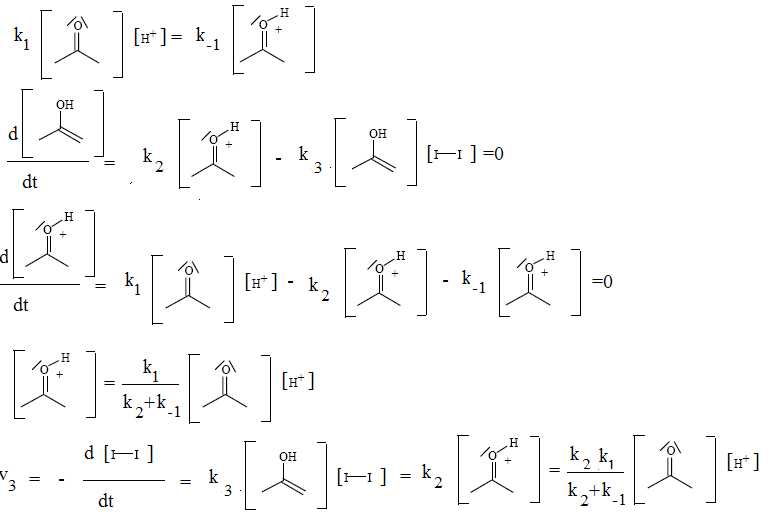Equilibre
céto-énolique ; cinétique de l'iodation de la propanone.
Concours agrégation 2004
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Equilibre
céto-énolique.
Les molécules comportant une liaison C-H sur le carbone voisin d’un
groupe carbonyle donnent lieu à l’équilibre suivant :
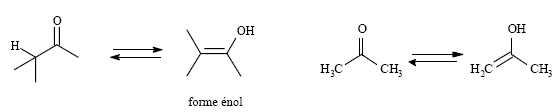
Quel
nom général porte ce type d’équilibre ?
Tautomérie céto-énolique.
Dans le cas de la propanone, l’enthalpie libre molaire standard
relative à cette réaction en phase aqueuse est DrG°
= 40,5 kJ.mol-1 à 25°C.
Calculer
la constante d’équilibre et le pourcentage de forme énol présente à
l’équilibre, à 25°C.
DrG°
=-RT ln K ; ln K = -DrG°
/(RT)=-40,5 103 /(8,314*298)= -16,35 ; K = 7,96
10-8 ~ 8 10-8.
K = [énol] / [cétone] =8 10-8
; la proportion d'énol est de l'ordre de 6 10-6
%.
Comment
définit-on une énergie de liaison ? Calculer l’enthalpie standard de la
réaction en phase gazeuse à partir des données fournies.
|
C-C |
C-H |
C-O |
C=O |
O-H |
C=C |
| D°(
kJ/mol) |
347 |
413 |
351 |
719 |
464 |
614 |
L'énergie de liaison
est l'enthalpie de dissociation de la liaison à la température T,
réactifs et produits étant gazeux.
Liaisons rompues : C=O ; C-H ; C-C ; liaisons créées : O-H ; C-O ; C=C.
DrH°
=D°(C-C)+D°(C-H)+D°(C=O)-D°(O-H)-D°(C=C)-D°(C-O).
DrH°
=347 +413 + 719 - 464 - 614 -351 = 50 kJ/mol.
Étude
cinétique de l’iodation de la propanone.
En milieu acide, il est possible de limiter l’halogénation d’une cétone
à la monohalogénation. Ainsi, en présence de diiode, la propanone
réagit selon le bilan :
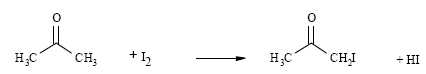
On se propose
d’analyser les données cinétiques obtenues par un suivi
spectrophotométrique dans le visible de cette réaction. On réalise
quatre expériences différentes à partir des conditions initiales
suivantes :
| Solution |
CH3COCH3 |
H+ |
I2 |
| S1 |
20 mL à
2 mol/L |
10 mL à
0,10 mol/L |
20 mL à 10-4 mol/L
|
| S2 |
20
mL à 2 mol/L |
10
mL à 0,05 mol/L |
| S3 |
20
mL à 1 mol/L |
10
mL à 0,10 mol/L |
| S4 |
20
mL à 1 mol/L |
10
mL à 0,05 mol/L |
|
| .
. |
|
|
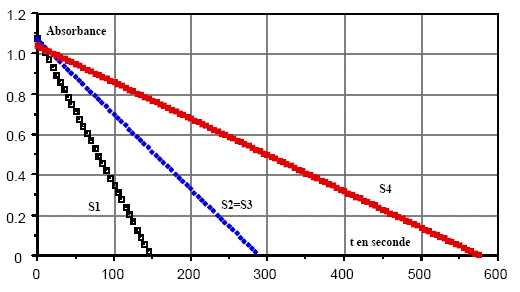
L'absorbance des
différents mélanges est suivie en fonction du temps :
Comment
définit-on l’absorbance ? Donner, dans le cas de cette expérience,
l’expression de la loi de
Beer-Lambert.
Un
spectrophotomètre mesure l'absorbance A (grandeur sans
unité) d'une solution diluée colorée contenue dans une cuve.
La
loi de Berr-Lambert exprime la variation de l'intensité lumineuse en
fonction de la distance parcourue dans un milieu transparent.
Lorsqu'une lumière monochromatique d'intensité I0
traverse un milieu homogène, l'intensité de la lumière émergente I
décroît exponentiellement lorsque l'épaisseur l du milieu absorbant
augmente.
I = I0
. e (- al)
a est une constante appelée coefficient d'absorption, caractéristique
du milieu et de la longueur d'onde considérés.
La relation fondamentale utilisée en spectrophotométrie est
présentée sous la forme :
A= log (I0/I)
= elc ( A est l'absorbance
ou densité optique)
Cette loi est vérifiée lorsque la solution est de
concentration inférieure à : c < 0,1 mol.L-1.
e (L mol-1
cm-1) est une caractéristique de la
molécule.
Plus e sera grand, plus la solution
absorbe.
l est l'épaisseur
de la
cuve (cm) et c
la concentration de la solution (mol/L).
Absorbance et concentration étant proportionnelles, cette
relation peut être utilisée pour réaliser des dosages ou des suivis
cinétiques.
Les solutions colorées présentent une longueur d’onde
lumineuse où l’absorption est maximale. Cette longueur d’onde maximale l max ne
dépend pas de la
concentration, c’est une grandeur caractéristique de l’ion absorbant.
|
.
|
|
Pourquoi
limite-t-on en général les mesures à des valeurs d’absorbance
inférieures à 1 ?
Lorsque l'absorbance passe de 1 à 2, le rapport I0/I
varie de 1 à 100. L'intensté transmise est très faible ; les
mesures sont moins précises.
Quelle
hypothèse simplificatrice peut-on faire compte tenu des compositions
initiales des solutions ?
Les concentrations de l'acétone et de l'ion oxonium sont très
supérieures à celles du diode. Les concentrations de ces deux réactifs
peuvent être considérées comme constantes.
Par suite la vitesse de la réaction peut s'écrire v = kapp
[I2]a avec
kapp = k [acétone ]ß[H+]d.
Déterminer
l’ordre partiel de réaction par rapport à I2.
v = 1/Vdx/dt = -d[I2]/dt avec x,
avancement de la réaction et V, volume de la solution.
Or A et [I2] sont proportionnels ; v
= -constante fois dA/dt = constante, les courbes d'équation A
= f(t) étant des droites.
En conséquence, l'ordre partiel de la réaction par rapport à I2
est nul.
Déterminer
les vitesses de réaction relatives aux différentes expériences. En
déduire les ordres partiels relatifs à H+, à la
propanone ainsi que la constante de vitesse.
D[I2] = 20/50*10-4
=4 10-5 mol /L ; v1
=D[I2]
/Dt= 4 10-5 / 150 =2,7 10-7
mol L-1 s-1.
v1 = k
[acétone ]ß[H+]d = k *(20*2/50)ß
(10*0,10/50)d
= k *0,08ß
*0,02d . (1).
v2
=v3= 4 10-5 / 280 =1,4 10-7
mol L-1 s-1.
v2
= k *(20*2/50)ß
(10*0,05/50)d
= k *0,08ß
*0,01d .
v3
= k *(20*1/50)ß
(10*0,10/50)d
= k *0,04ß
*0,02d .
0,08ß
*0,01d =0,04ß
*0,02d ; 2ß
=2d
;
ß = d.
(2).
v4 = 4 10-5 /575 =7 10-83
mol L-1 s-1.
v4
= k *(20*1/50)ß
(10*0,05/50)d
= k *0,04ß
*0,01d . (3)
v1/v2 = 2,7 / 1,4
~1,9= 2d ; d ~1 ; ß~1.
(1) s'écrit : k = 2,7 10-7 /(0,08*0,02)~1,7 10-4
L mol-1 s-1.
|
|
|
On peut proposer, en milieu acide, le mécanisme suivant : 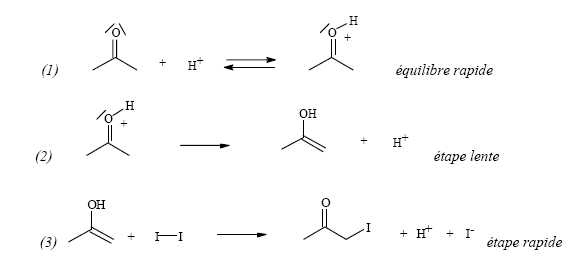
Quelles hypothèses cinétiques peut-on faire ? Quelles approximations peut-on en déduire ?
L'équilibre
(1) est rapide ; l'énol est consommé dans l'étape (3) rapide. L'énol ne
s'accumule pas, on peut lui appliquer l'hypothèse des états
quasi-stationnaires.
Montrer alors que le mécanisme proposé est en accord avec la loi cinétique expérimentale
(on pourra noter k1, k-1, k2, k3 les constantes de vitesses des diverses réactions).
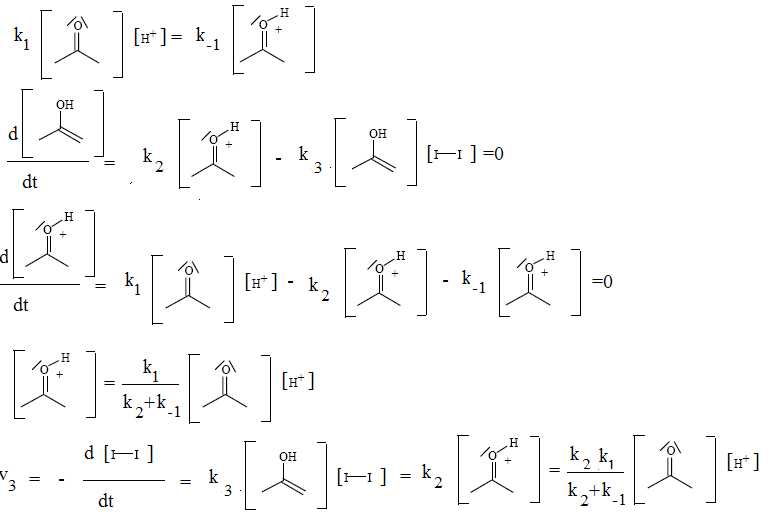
|
|
|