Synthèse de
la(-)-Bulgecinine. Second
concours, école normale supérieure
2012
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
|
| .
. |
|
|
Le
composé 6 réagit dans un premier temps avec un équivalent de chlorure
de N-benzyloxycarbonyle (noté Cbz-Cl) en présence de triéthylamine dans
le diméthylformamide (DMF) pour conduire au composé 7 de formule brute C15H21NO6. Le spectre infrarouge du composé 7 montre une bande d’absorption intense à 1660 cm–1 en infrarouge.
33. Le chlorure de N-benzyloxycarbonyle réagit comme un chlorure d’acyle classique.
Donner la structure du composé 7 ainsi que le mécanisme de sa formation. Quel est le rôle de la triéthylamine ? Justifier.
On obtient un amide. La triméthylamine est une base neutralisant l'acide formé.
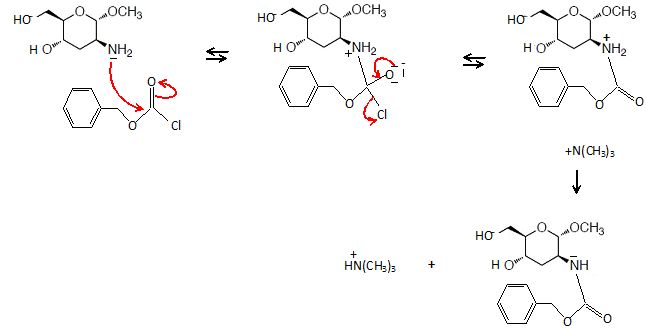
34. Attribuer les signaux observés en IR pour le composé 7.
Le signal à 1660 cm-1 correspond à la liaison dN-H des amides ainsi qu'à la liaison nC=O de l'amide. Ces bandes se recouvrent.
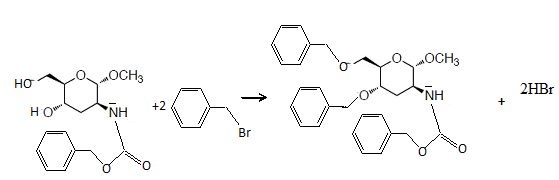
Le composé 7 réagit ensuite avec deux équivalent de bromure de benzyle
(noté Bn-Br) en présence d’hydroxyde de sodium dans le DMF pour
conduire au composé 8 de formule brute C29H33NO6.
35. Donner la structure du composé 8, ainsi que l’équation de réaction de la transformation de 7 en 8.
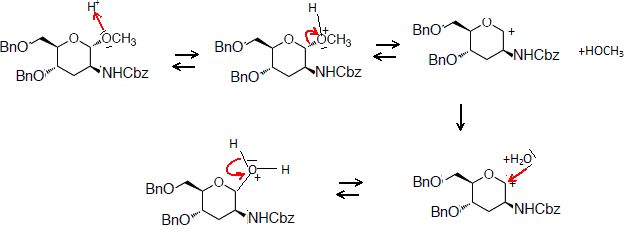
Le composé 8 est ensuite hydrolysé en présence d’acide chlorhydrique
concentré et d’acide acétique pour donner un mélange non séparable de
deux stéréoisomères 9 et 9’.
36. Donner le
mécanisme de formation des deux stéréoisomères 9 et 9’. Quelle relation
de stéréochimie existe entre les composés 9 et 9’?
9 et 9' sont deux énantiomères.
|
|