Autour
de l'azote, racémisation de la base de Tröger. Second concours, école
normale supérieure
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. La
famille de l'azote
Les
éléments azote (N), phosphore (P) et arsenic (As) se trouvent dans la
même colonne du tableau périodique.
1.1-
Ces trois atomes présentent-ils une couche de valence isoélectronique ?
N ( Z=7) : 1s2 2s2 2p3
; P ( Z=15) : 1s2
2s2 2p6 3s2
3p3 ;
P ( Z=33) : 1s2
2s2 2p6 3s2
3p6 3d10 4s2
4p3.
La couche de valence de ces trois éléments compte 5 électrons.
1.2-
Combien de liaisons covalentes peuvent être établies par ces
éléments en supposant une charge formelle égale à +1 pour N, As et P ?
En établissant trois liaisons de covalence, ces éléments complètent à
huit leur couche électronique externe.
1.3-
Pour quelle raison les
composés du phosphore et de l'arsenic peuvent-ils conduire à des
composés possédant 5 à 6 liaisons covalentes ( AsCl5
ou PCl6- par exemple).
La couche
électronique 3 d est proche, d'un point de vue énergétique, et vacante.
1.4-
Justifier l'évolution observée pour les rayons atomiques et pour
l'énergie de première ionisation de l'azote, du phosphore et de
l'arsenic.
| Elément |
N |
P |
As |
| Z |
7 |
15 |
33 |
| Rayon
atomique ( pm) |
88 |
128 |
139 |
| EI
( eV) |
14,5 |
11 |
9,8 |
L'énergie
de première ionisation diminue de haut en bas d'une même colonne du
tableau périodique, du fait de l'effet d'écran croissant des électrons
de coeur.
L'énergie de première ionisation diminue
en descendant un groupe : les orbitales électroniques s'expandent de
plus en plus lorsque le nombre quantique principal n augmente. Les
électrons de valence occupent une région de l'espace de plus en plus
lointaine du noyau ( le rayon atomique croît ) et seront donc plus
faciles à arracher à l'élément.
2.
Dérivés oxydés de l'azote.
2.1- Donner le
nombre d'oxydation de l'azote dans chacun des dérivés oxygénés de
l'azote : NO3- ; NO2
; HNO2.
NO3-
: n.o(N) +3(-2)=-1 ; n.o(N) = V.
NO2 :
n.o(N) +2(-2)=0 ; n.o(N) = IV.
HNO2 :
n.o(N) +1+2(-2)=0 ; n.o(N) = III.
2.2- Ecrire la
formule de Lewis de NO et N2O.
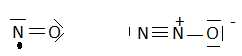
2.3-
Ecrire la demi-équation de transfert électronique et la relation de
Nernst correspondante pour le couple oxydant réducteur NO3-aq
/ NO2(g).
NO3-aq + 2H+aq
+e- = NO2(g) +H2O(l).
(1)
E1=E°( NO3-aq
/ NO2(g) ) +0,06 log ( [NO3-aq][H+aq]2 / PNO2).
E1 = 0,83 +0,06
log ( [NO3-aq][H+aq]2 / PNO2).
|
| .
. |
|
|
2.4- En présence
d'eau, le dioxyde d'azote peut se dismuter en ion nitrate NO3-aq
et en ion nitrite NO2-aq
suivant la réaction à équilibrer.
2NO2(g) + H2O (l) = NO3-aq
+ NO2-aq
+ 2H+aq.
(3)
2.5-
Exprimer la constante K en fonction de la pression partielle PNO2
en bar du dioxyde d'azote et des concentrations des espèces en solution
aqueuse. Calculer K.
K= [NO3-aq][NO2-aq][H+aq]2
/ P2NO2.
NO2(g)
+e- = NO2-aq
(2).
E2
=E°( NO2(g)/NO2-aq
/
) +0,06 log ( [PNO2 /
NO2-aq].
E2 = 0,85 +0,06
log ( [PNO2 /
NO2-aq].
A l'équilibre E1=E2 ;
0,06
log ( [NO3-aq][H+aq]2 / PNO2
)-0,06
log ( [PNO2 /
NO2-aq].=
0,85 -0,83.
0,06 log K = 0,02 ; log K =0,02 / 0,06 =0,333 ; K =2,15 ; K=2,2.
2.6-
Une atmosphère de pression totale 1 bar, chargée en dioxyde d'azote, se
trouve en équilibre avec une eau de pH = 4,0, l'acidité provenant de la
réaction de dismutation de NO2 dans l'eau.
Déterminer la pression partielle PNO2.
La solution est électriquement neutre : [NO3-aq]
+ [NO2-aq]=[H+aq].
D'après les nombres stoechiométriques de (3) : [NO3-aq]
= [NO2-aq]
= ½[H+aq].
K s'écrit : K = 0,25
[H+aq]4
/ P2NO2.
P2NO2
=
0,25
[H+aq]4
/ K = 0,25 10-16 /2,15 =1,16 10-17
; PNO2 =3,4
10-9 bar.
|
|