Synthèse de
l'ipsénol :
concours DGCCRF 2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
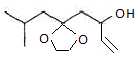
L'ipsénol A
( C10H18O ) est la
phéromone sexuelle de la mouche du pin. On étudie sa synthèse à partir
du composé B, représennté ci-dessous :
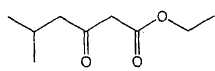
Nommer la molécule B. 5-méthyl-3-oxohexanoate
d'éthyle.
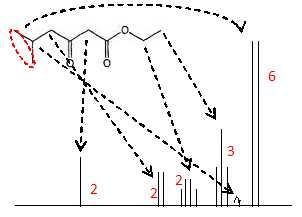
Prévoir la nature des pics ( hauteur et multiplicité du spectre RMN 1H
de B.
Le
composé B réagit avec l'éthane-1,2-diol en présence d'acide pour donner
C de formule brute C11H20O4.
Indiquer la structure de C et donner le mécanisme de la réaction
conduisant à sa formation. Nommer les groupes caractéristiques présents
dans C.
Protection
du groupe carbonyle : 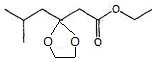
C contient le groupe ester et le groupe acétal cyclique.
En utilisant des notations simplifiées :
..
|
| .
. |
|
|
Par
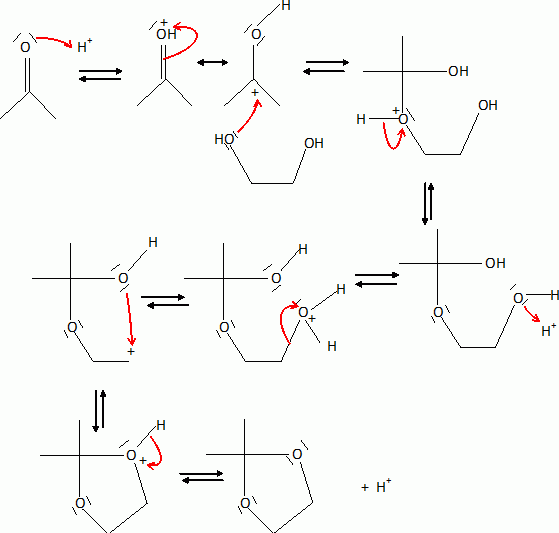
action du tétrahydruroaliminae de lithium, suivie d'une hydrolyse
acide, C est transformé en D. D présente en spectroscopie IR une bande
d'absorption forte et large vers 3300 cm-1.
Quelle est la
nature du ractif tétrahydruroaluminate de lithium ? Donner la formule
topologique de D. Expliquer le rôle de l'étape de B à C.
LiAlH4 est un réducteur fort ( il
fournit des ion hydrure H-). Il réduit l'ester en alcool.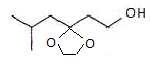
Le groupe carbonyle est protégé par la formation d'un
acétal cyclique avant
réduction par LiAlH4.
L'oxydation
douce de D donne E. Quelle est la formule semi-développée de E ?
Justifier le terme oxydation douce. Proposer un réactif permettant de
réaliser cette oxydation.
L'oxydation
douce par CrO3 + acide sulfurique conduit à
l'aldehyde ; la chaîne carbonnée est conservée. 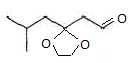
Comment peut-on vérifier, à l'aide de méthodes spectroscopiques la
formation de E.
En
spectroscopie IR, disparition de la bande large et forte vers 3300 cm-1 et apparition d'une bande
forte, fine vers 1700 cm-1.
En RMN 1H apparition d'un singulet vers
10 ppm ( proton du groupe aldehyde ).
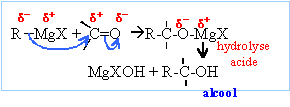
E réagit avec le chlorure de vinylmagnésium H2C=CH-MgCl
et après hydrolyse en milieu faiblement acide, un composé F est ontenu.
Indiquer la structure de F et donner les schémas réactionnels des
étapes conduisant à F. Pourquoi l'hydrolyse doit-elle être effectuée en
milieu faiblement acide ?
Les
magnésiens étant des bases fortes, l'hydrolyse forme Mg(OH)2 (s),
solide blanc. On évite la formation de l'hydroxyde de magésium en
hydrolysant en milieu acide ( solution de NH4Cl ou acide
sulfurique dilué).
|
.
|
|
Une
oxydation douce à l'aide du réactif de Jones ( CrO3
+H2SO4) de F donne G.
Donner la formule de G. Le spectre infrarouge présente entre autres,
deux bandes à 1618 et 1690 cm-1. Attribuer ces
deux bandes et commenter.
1690 cm-1 : cétone conjuguée
avec la double liaison C=C. ( effet batochrome ).
1618 cm-1 : double liaison C=C
conjuguée avec le groupe carbonyle. ( effet batochrome ).
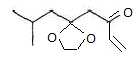
Le
composé G est transformé en H par une réaction de Wittig utilisant
comme produit de départ l'iodure de méthyle et la triphénylphosphine P(C6H5)3.
La
première étape est la synthèse de l'ylure de phosphore, elle comporte
une substitution nucléophile suivie d'une réaction acidobasique. Donner
les équations de ces deux étapes et proposer une base.
Substitution
nucléophile de la triphénylphosphine sur un dérivé
halogéné dans l'acétone.
PPh3
+CH3I --->Ph3 P+--CH3
+ I-.
Ph3 P+--CH3
+ nBuLi ---> Ph3 P+--CH2-
+ BuH. (
solvant THF ).
[ Ph3 P+--CH2-
<---> [Ph3 P=CH2 ].
La réaction de Wittig est qualifiée d'addition nucléophile. Justifier.
La
première étape est une attaque nucléophile sur le carbone déficitaire
en électrons du groupe carbonyle ; la seconde étape est une
élimination.
Donner
la formule de H ainsi que l'équation et le mécanisme de son obtention à
partir de l'ylure de phosphore préparé et le composé G.
|
|
|
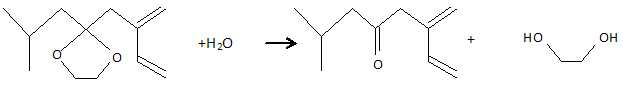
H
est hydrolysé à chaud en présence d'acide chlorhydrique et conduit à I.
Donner l'équation de la réaction et la formule de I.
I
est traité par le tétrahydroborurate de sodium dans l'éthanol. Après
hydrolyse acide, l'ipsénol A est isolé. Quelle est la formule de A ?
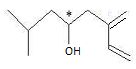
L'ipsénol ainsi synthétisé est-il
optiquement actif ? Expliquer cette propriété.
A
possède un atome de carbone asymétrique : il est optiquement actif. Les
deux énantiomères dévient le plan de polarisation de la lumière
polarisée. Ils sont images l'un de l'autre dans un miroir, donc non
superposables.
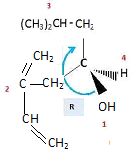
Représenter l'isomère R de l'ipsénol.
|
|
|