Traitement du gaz
naturel, combustion du méthane. Concours général Stl 2014
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
Traitement du
gaz naturel.
Le
gaz naturel contient essentiellement du méthane, mais sa composition
est variable selon les gisements ; la présence d’autres gaz, comme par
exemple le sulfure d'hydrogène H2S, peut être problématique
et le gaz naturel doit donc être traité avant utilisation comme
combustible.
En effet, le sulfure d'hydrogène présente deux caractéristiques qui
justifient qu’on veuille l’éliminer :
- il possède des propriétés acides susceptibles d'endommager les
matériaux utilisés pour son transport ou dans la centrale ;
- sa combustion libère des oxydes de soufre toxiques et éventuellement
responsables de pluies acides.
Le mélange de H2S et CO2 constitue ce qu'on
appelle usuellement le gaz acide. Il est extrait du gaz naturel brut
par un procédé utilisant des amines comme l'éthanolamine H2N−CH2−CH2−OH
ou la méthyldiéthanolamine (MDEA) en solution aqueuse.
Lors de la dissolution du sulfure d’hydrogène H2S dans une
solution aqueuse, un équilibre s’établit entre le gaz dissous dans
l’eau H2S(aq) et le gaz en contact avec la solution H2S(g).
Cet
équilibre est régi par une relation entre la pression de H2S
et sa concentration dans la solution. Le rapport de ces deux grandeurs
à l’équilibre définit la constante de Henry, notée kH =[H2S
aq] PH2S.
La valeur de kH à la température de l’expérience est de 0,10
mol.L-1.bar-1.
La pression totale du gaz est portée autour de 70 bar lors de la
désulfuration. La pression de H2S au sein du mélange gazeux
est variable selon la composition du gaz d'origine.
Suite à la dissolution des gaz dans la solution, on observe les
réactions suivantes :
(a) H2S(aq) + MDEA(aq) = HS−(aq) + MDEA−H+(aq)
(b) CO2(aq) + H2O(l) + MDEA(aq) = HCO3−(aq)
+ MDEA−H+(aq)
Étant donnée la forte concentration en MDEA dans les solutions
utilisées, le pH de la solution est très peu affecté par les réactions
(a) et (b) et reste voisin de 11,5.
Les produits sont ensuite récupérés pour valoriser le soufre sous forme
d'acide sulfurique.
Indiquer
quel est le rôle de l'amine dans les réactions (a) et (b) en
identifiant l'origine de cette réactivité au niveau moléculaire.
La basicité d'une amine est due au doublet non liant porté par l'atome
d'azote.
Expliquer
pourquoi l'éthanolamine est très soluble dans l'eau.
L'eau comme l'éthanolamine ( présence de l'atome d'azote et du
groupe hydroxyle ) sont des molécules polaires.
Exprimer
K°(a), constante d'équilibre thermodynamique de la réaction (a) à
l'aide des constantes d'acidité Ka
des couples mis en jeu. Déterminer la valeur de K°(a) et commenter sa
valeur en lien avec le but recherché lors de ce traitement.
K°(a) = [HS−(aq)][MDEA−H+(aq)] /([MDEA(aq)][H2S(aq)]).
Or Ka1 = [HS−(aq)][H3O+aq]
/ [H2S(aq)] et Ka2 = [MDEA(aq)][H3O+aq]
/ [MDEA−H+(aq)].
K°(a) =Ka1 /Ka2 = 10-7,0 / 10-8,6 = 101,6
=39,81 ~40.
K°(a) est grande, la réaction est totale.
Pour un gaz contenant 3 % (en quantité de matière) de H2S,
la pression de H2S au sein du mélange gazeux est voisine de
2 bar lors de la désulfuration. Estimer la
concentration totale en espèce soufrée que l'on peut extraire du gaz
par la solution de MDEA.
kH =[H2S aq] PH2S = 0,10 ; [H2S
aq]=0,10 PH2S
=0,10*2 = 0,20 mol/L.
Estimer le volume de
solution de MDEA
nécessaire à la désulfuration du gaz nécessaire au fonctionnement
annuel de la centrale étudiée si celui-ci contient 90 % de méthane.
La centrale consomme l'équivalent de 25×109 kWh de gaz
naturel par an. Pouvoir calorifique inférieur (PCI) du méthane à l’état
gazeux : 13,9 kWh / kg.
Le méthane correspond à : 25×109 *0,90 = 2,25 1010
kWh ou 2,25 1010 /13,9 =1,62 109
kg ou 1,62 109 / 0,016 =1,0 1011 moles.
Quantité de matière de H2S : 1,0 1011 *3/100 =3,0 109
moles.
Quantité de matière de MDEA : 3,0 109 moles.
Dans l'hypothèse où la concentration en MDEA est 10 mol/L, volume
de solution de MDEA : 3,0 109 /10 = 3 108 L.
|
| ..
.. |
|
|
Proposer un
traitement envisageable pour libérer à nouveau H2S après
la séparation entre la solution et le gaz naturel purifié. On
pourra utiliser un diagramme de prédominance des espèces présentes en
fonction du pH.
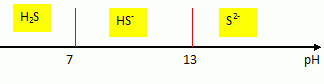
Passer en milieu acide puis chauffage ( vers 140°C ) dans une colonne
de désorption
Le sulfure d'hydrogène récupéré est oxydé en
présence de dioxygène pour
donner du soufre S(g) par le procédé Claus : réactions (c) et (d).
(c) H2S(g) + 1,5 O2(g) = H2O(g) + SO2(g)
(d) 2 H2S(g) + SO2(g) = 2 H2O(g) + 3
S(g).
Le soufre S(g) réagit avec O2(g) pour donner du trioxyde de
soufre SO3(g) : réaction (e). Le trioxyde de soufre est
ensuite transformé en acide sulfurique H2SO4(l)
par réaction avec l'eau : réaction (f).
Écrire
les équations des réactions (e) et (f).
(e) : S(s) +1,5 O2(g) = SO3(g).
(f) : SO3(g) +H2O(l) = H2SO4(l).
Une solution d'acide sulfurique pourrait être
obtenue par oxydation de H2S(aq).
Indiquer
quel peut être l'avantage principal de la série de réactions (c) à (f).
Moindre consommation d'énergie et meilleur rendement.
|
.
|
|
Combustion du
méthane.
Définir
le terme combustion et justifier en quoi l'appellation combustible est
discutable dans le cas de l'uranium utilisé dans les centrales
nucléaires pour la production électrique.
La combustion est une réaction exothermique d'oxydoréduction.
Lors de la fission de l'uranium, il s'agit de réactions nucléaires.
Écrire l’équation de la réaction de combustion complète du méthane
à une température supérieure à 100 °C en précisant les états physiques
des différentes espèces chimiques impliquées.
CH4(g) + 2O2(g) ---> CO2(g) + 2H2.O(g). DrH° = -0,22 kWh /mol.
En supposant que l'énergie libérée au cours de la combustion est
intégralement transférée aux gaz produits, déterminer la valeur de la
variation de température des gaz formés lors de la combustion.
Commenter le résultat. Capacité thermique molaire du mélange de gaz issus de la combustion d'une mole de méthane en absence de gaz inerte : Cm = 2,8 10-5 kWh K-1 mol-1.
L'énergie libérée par la combustion sert à chauffer les produits de la combustion : -DrH° = Cm DT ;
DT = 0,22 / (2,8 10-5 )=7,9 103 K
La combustion est rarement mise en oeuvre avec des réactifs purs :
l'air est utilisé comme comburant. Dans ces conditions la variation de
température du mélange gazeux obtenu en fin de réaction est plus faible
que celle calculée précédemment et la température atteinte par les gaz
produits est environ 500 °C.
Indiquer quels autres phénomènes sont
susceptibles de diminuer la variation de température du mélange gazeux
obtenu.
L'énergie libérée sert également à chauffer le milieu environnant.
Lors de la combustion dans l'air, le diazote ( ~80 % de l'air, gaz inerte) , est également chauffé.
Citer deux raisons justifiant l'utilisation du méthane de
préférence à d'autres hydrocarbures gazeux dans ce type d'installation.
Le pouvoir calorifique inférieur du méthane est supérieur à celui du propane, du butane et de l'heptane.
Le gaz naturel ( ~90% de méthane ) est abondant et assez bon marché.
Par une analyse
des transferts énergétiques mis en jeu dans la turbine à gaz, indiquer
quels sont les paramètres qui peuvent être optimisés pour son bon
fonctionnement.
La
turbine à gaz fonctionne grâce aux gaz issus de la combustion à
haute température. A la sortie, les fumées sont encore chaudes ( 400 à
650 °C). Celles-ci permettent de générer de la vapeur d'au dans une
chaudière au moyen d'échangeurs de chaleur. Cette vapeur entraîne une
turbine à vapeur. Une source froide ( eau de rivière, aéroréfrigérant
) évacue la chaleur produite par le cycle vapeur.
Pour améliorer l'efficacité d'une chaudière, il faut minimiser les
pertes thermiques. Prévoir plusieurs niveaux de pression ; récupération
de la chaleur contenue dans les fumées.
Choisir des condenseurs à eau en milieu ouvert en cas de disponibilité
d'eau en grande quantité. Ces derniers ont de bons rendements.
Estimer la quantité de matière totale de gaz (air humide et dioxyde de carbone) rejetée par une centrale à cycle combiné gaz. En
déduire le transfert thermique cédé par le mélange gazeux (qu'on
assimilera à de l'air) au sein de la chaudière et le rendement de
l'ensemble {chaudière − turbine à vapeur − alternateur n°2} en
admettant que les gaz d'échappement atteignent une température
d'environ 20 °C à la sortie de l'installation. Cm air=8,1 10-6 kWh mol-1.
Quantité de matière de méthane = quantité de matière de dioxyde de carbone ~ 1011 moles.
Quantité de matière totale de gaz : n=1011 /0,04 = 2,5 1012 moles.
Transfert thermique : Q = nCm air DT = 2,5 1012 *8,1 10-6 (20-500)= -9,7 109 kWh.
Production électrique de la turbine à vapeur : 5 109 kWh ; rendement 5 / 9,7 ~0,52
|
|
|