Connaissances
générales en chimie. Concours Atrfp2 Lille
2015
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice
1.
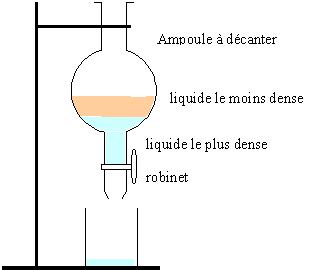
1. Une extraction
liquide-liquide. Dessinez le schéma du montage
Les liquides utilisés sont l’eau et le cyclohexane (d =0,78). Précisez
les positions des phases organique et aqueuse. Indiquez la formule
brute de l’eau et du cyclohexane. Indiquez à quelle famille appartient
le cyclohexane.
La phase la plus dense, l'eau, occupe la partie inférieure de l'ampoule
à décanter.
H2O et C6H12,
cycloalcane.
2 .
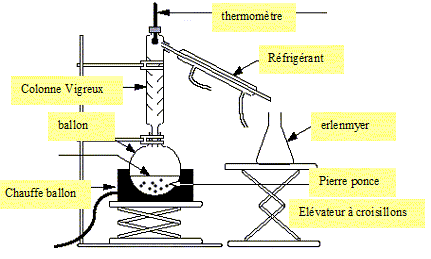
Une distillation de séparation d’un mélange alcool eau.
Dessinez le schéma du montage. Indiquez le sens de circulation de l’eau.
Citez le nom d’un alcool et donnez sa formule brute. Donnez le groupe
fonctionnel ou caractéristique d’un alcool .
Ethanol C2H6O, groupe
fonctionnel OH ( hydroxy) fixé sur un carbone tétragonal.
3.
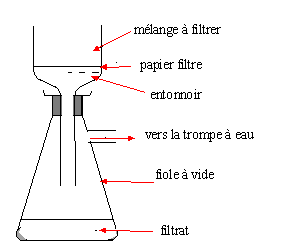
Une filtration sur Büchner.
Dessinez le schéma du montage. Le vide est-il nécessaire ? Si oui,
précisez le matériel utilisé
Précisez les positions du filtrat et du filtré.
|
| .
. |
|
|
Exercice 2.
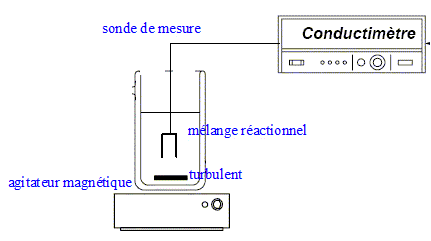
Conductimètre
Décrivez l’appareil. Expliquez simplement le protocole
d’utilisation.
La
partie inférieure de la sonde du conductimètre est creusée d'une
lucarne ; cele ci doit être immergée dans la solution dont on mesure la
conductivité. La constante de cellule est cacartéristique de la sonde ;
elle dépend de la distance des deux faces en regard de la lucarne et de
la surface des faces en regard.
Quelle est la méthode de stockage de la cellule ?
Quelle est la grandeur de mesure et son unité ?
il est nécessaire
d'étalonner le conductimètre : réglage
de la température ( la conductivité
dépend de la température) et connaitre la
constante de cellule ou caractéristiques de la sonde
de mesure donnée par le constructeur.
Le fabricant de
conductimétres fournit une table de la
conductivité d’une solution de chlorure de
potassium à 0,1 mol/L pour toutes les
températures allant de 15,0 et 30,0°C. Mesurer
la conductance de cette solution de chlorure de potassium et
la température de la solution ; cette table permet de
déterminer la constante de la cellule
utilisée. Un potentiométre
d’étalonnage permet d’ajuster la valeur
lue.
Ce appareil donne la conductivité de la solution en siemens mètre-1 ( S m-1).
Stockage court : eau distillée ; stockage long : à sec. Réhydraté dans l'eau distillée avant une nouvelle utilisation.
Exercice
3.
On vous demande de préparer une solution d’acide chlorhydrique 3M.
Les informations indiquées sur la bouteille commerciale sont :
Acide Chlorhydrique 3 7%, d= 1,19, M(HCl)=36,48 g /mol.
Quelle est la concentration molaire de cette bouteille ?
Préciser ensuite les calculs pour réaliser 500 mL d’une solution 3M.
Décrire le mode opératoire ainsi que le matériel utilisé pour réaliser
cette solution demandée à 3M.
Masse d'acide dans 1 L de
solution commerciale : m = 1,19 *0,37 = 0,4403 kg = 440,3 g
Concentration C = 440,3 / 36,48 =12,07 ~12,1 mol/L.
Facteur de dilution F = 12,07 / 3 =4,02.
Volume de solution commerciale à prélever ( à l'aide d'une burette
graduée) = 500 / 4,02 ~124 mL.
Verser dans une fiole jaugée de 500 m L contenant 1/3 d'eau distillée.
Compléter
avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre
homogène.
Quel
volume faut-il prélever de la solution que vous venez de préparer pour
obtenir 100 mL d’une solution B diluée 10 fois, décrivez votre calcul
et
le mode opératoire.
Prelever 10 mL de la solution précédente à l'aide d'une pipette jaugée.
Verser dans une fiole jaugée de 100 m L Compléter
avec de l'eau distillée jusqu'au trait de jauge. Agiter pour rendre
homogène.
|
|
|
|
Exercice
4.
On vous demande d’extraire l’eugénol d’une solution aqueuse.
Indiquez 2 critères à prendre en compte dans le choix du solvant
extracteur.
L'eugénol doit être très soluble dans le solvant extracteur et ce
solvant ne doit pas être miscible avec l'eau.
Quel solvant choisissez-vous ? Ether.
Quelle précaution doit-on prendre pour manipuler le solvant choisi ?
L'éther est inflammable, travailler hors de toutes flammes.
Exercice
5.
Quelles
sont les unités de mesure et leur symbole ?
Masse volumique : kilogramme par mètre cube kg m-3
; poids : newton N ; tension : volt V ;
pression atmosphérique : hectopascal hPa ; pH ( sans unité) ;
température : dgré celcius °C, kelvin K.
Exercice
6.
Donner les formules des composés suivants et
écrire la formule des ions obtenus lors de la mise en solution aqueuse
de ces composés.
Chlorure de calcium : CaCl2(s) --> Ca2+aq
+ 2Cl-aq.
Chlorure de fer (II) : FeCl2(s)---> Fe2+aq
+ 2Cl-aq.
Chromate de potassium : K2CrO4(s)
---> 2 K+ aq+CrO42-aq.
Thiocyanate de sodium : NaSCN (s) ---> Na+ aq
+ SCN-aq .
Nitrate d'argent : AgNO3(s) ---> Ag+aq
+ NO3-aq.
Exercice 7.
Compléter le
tableau.
| Nom |
nitrate d'argent |
acétone |
Sulfate de
potassium |
Sodium |
ac éthanoïque |
Soufre |
Magnésium |
Aluminium | Butan-1-ol | ammoniac |
| Formule |
AgNO3 |
C3H6O |
K2SO4 |
Na |
CH3COOH |
S |
Mg |
Al | CH3(CH2)3OH | NH3 |
8. Convertir et utiliser l'écriture scientifique.
0,203 g =203 mg = 2,03 102 g.
1,3 µL = 1,3 10-3 mL.
450 mmol = 0,45 mol =4,5 10-1 mol.
HCl, c = 10-3 mol/L : pH = - log c= 3.
25 dm3 =25 L = 2500 cL = 2,5 103 cL.
354 kcal = 354 *4,18 kJ ~1480 kJ = 1,48 106 J.
|
|
|
|



