Chimie générale ;
concours d'accès au cycle Master 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
I. Soit la réaction de décomposition suivante :
2HgO(s) = 2Hg(g) + O2(g).
A la température de 420°C, la pression totale est de 387 mm Hg et à la température de 450°C elle est de 810 mm Hg.
1. Calculer les pressions partielles à ces deux températures.
|
Avancement (mol)
|
2HgO(s)
|
=2Hg(g)
|
+O2(g)
|
Initial
|
0
|
n
|
0
|
0
|
Final
|
x
|
n-2x
|
2x
|
x
|
Nombre total de moles gazeuses à l'état final : 3x.
Fraction molaire : dioxygène : x / (3x )= 1/3 ; mercure : 2x / (3x) = 2/3.
Pression partielle du dioxygène : PO2 = P / 3 ;
pression partielle du m"rcure : PHg = 2P/3.
A 420°C : PO2 =387/3 = 129 mm Hg ; PHg = 2*387/3 =258 mm Hg.
A 450°C : PO2 =810/3 = 270 mm Hg ; PHg = 2*810/3 =540 mm Hg.
2. Calculer la constante d'équilibre à ces deux températures.
KP=P2Hg PO2.
A 420°C : Kp=2582 *129=8,59 106 (mm Hg)3.
A 450°C : KP =5402 *270=7,87 107 (mm Hg)3.
3. Calculer la variation d'enthalpie de cette réaction supposée constante dans cet intervalle de température
Loi de Van't Hoff : d ln KP /dT = DH / (RT2).
Intégrer : ln( KP 1 / KP 2)=-DH/R [1/T1-1/T2]
L'indice 1 correspond à 420°C soit 420+273 =693 K et l'indice 2 correspond à 450+273 =723 K.
ln (8,59 106 / (7,87 107))= -2,215.
1/T1-1/T2 =1/693 -1/723=5,99 10-5.
DH = 2,215*8.314 / 5,99 10-5 = 3,08 105 J.
|
| .
. |
|
|
II. Représenter le diagramme d'énergie de la molécule Ne2 ( Z=10).
1. Donner sa configuration électronique.
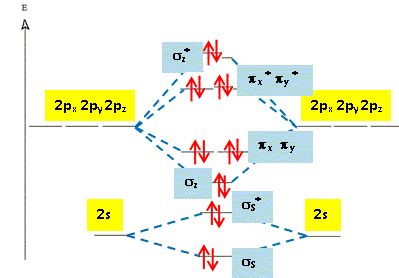
2. Calculer son ordre de liaison et conclure.
L' indice de liaison égal
à zéro. ( nombre d'électrons dans les
orbitales liantes - nombre d'électrons dans les
orbitales antiliantes ) divisé par
2.
La molécule Ne2 n'existe pas.
|
|
|
|
III. Donner les structures de Lewis des édifices suivants :
POCl3 ; SO2 ; H3O+ ; HNO3.

|
|
|
|