Acide base ;
concours Fesic 1997.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
1. On prépare uns solution de soude en dissolvant 0,2 g de soude dans 100 mL d'eau. On donne log 2 = 0,30.
a. La concentration de la solution est égale à 0,05 mol/L. Vrai.
M(NaOH) = 40 g/mol ; n = m / M = 0,2 / 40 = 5 10-3 mol ; C = n / V = 5 10-3 / 0,1 = 0,05 mol/L.
b. Le pH de la solution est égal à 12,7. Vrai.
pH d'une base forte pH = 14 + log C = 14 + log 0,05 = 14 + log(1/ (2*10) = 14 -log2-log10 =12,7.
c. La soude est une base faible car son pH est inférieur à 14. Faux.
d. Au sens de Bronstëd, pour une solution de soude, la base forte est l'ion hydroxyde HO-. Vrai.
2.
Sur l'étiquette d'une bouteille d'acide chlorhydrique commercial, on
lit : densité d = 1,19 ; % en masse 37%. Le préparateur d'un
lycée fabrique un litre d'une solution de cet acide dilué 100
fois et le dose en utilisant 10 mL d'une solution d'hydroxyde de sodium
de concentration connue en présence d'un indicateur coloré. Le virage
de l'indicateur a lieu quand il a versé un volume V = 15 mL de solution
acide dilué.
a. Pour préparer la solution diluée le préparateur a prélevé 1 mL d'acide commercial. Faux.
Masse d'acide pur dans la solution commerciale : m = 1,19 *0,37 =0,44kg.
Quantité de matière d'acide dans un litre : 440 / M(HCl) =40 / 36,5 ~12 mol/L.
Pour préparer un litre de solution diluée 100 fois, il fautprélever 10 mL de solution commerciale.
Concentration de la solution diluée : 0,12 mol/L.
b. La concentration de la solution de soude est égale à 0,18 mol/L. Vrai.
A l'équivalence : quantité de matière de soude = quantité de matière d'acide = 0,12*15 =1,8 mmol.
Concentration de la soude : 1,8 / 10 = 0,18 mol/L.
c. L'indicateur le plus approprié est le bleu de bromothymol. Vrai.
Le
pH à l'équivalence d'un dosage acide fort - base forte est égal à 7. La
zone de virage de l'indicateur doit contenir le pH du point équivalent.
d.
Si on recommence le dosage avec une solution d'acide éthanoïque de
concentration 0,12 mol/L, le volume de solution d'acide à verser pour
obtenir l'équivalence est supérieur à 15 mL. Faux.
3. Les ions iodures sont oxydés lentement par les ions peroxodisulfate S2O82-.
2I- +S2O82- --> I2 + 2SO42-.
L'ion Fe3+ catalyse cette réaction.
E°(S2O82- /SO42-) =2,01 V ; E°(Fe3+ /Fe2+)=0,77 V ; E°( I2 /I- )=0,53 V ; E°(Cr3+ /Cr2+)= -0,41 V.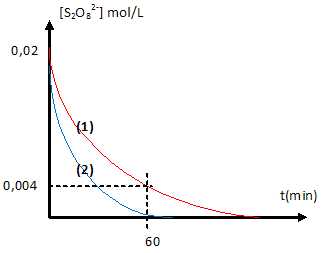
a. La catalyse par les ions Fe2+ est hétérogène. Faux.
Catalyseur et réactifs sont dans la même phase.
b. La catalyse par les ions Cr3+ est thermodynamiquement imposible. Vrai.
E°(Cr3+ /Cr2+) nest pas compris entre E°(S2O82- /SO42-) et E°( I2 /I- )=0,53 V.
c. A t= 60 min, [I2]=1,6 10-2 mol/L. Vrai.[I2] = [S2O82- ]réagi =0,02-0,004 = 1,6 10-2 mol/L.
d. On recommence la même expérience à une température différente q2.( courbe 2).
q2 est inférieure à q1. Faux.
La température est un facteur cinétique.
4.
V=10 mL d'une solution d'acide fort et V=10 mL d'une solution d'acide
faible sont dosés pH-métriquement à l'aide d'une solution de soude de
concentration cb = 0,100 mol/L.
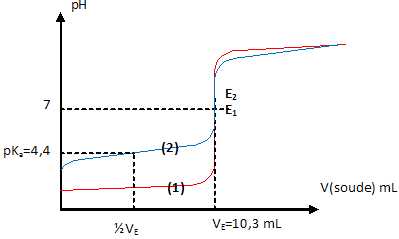
a.
Les courbes 1 et 2 correspondent au dosage par la soude respectivement
de la solution d'acide fort et de la solution d'acide faible. Vrai.
b. Les deux solutions ont la mêmeconcentration 0,103 mol/L. Vrai.
A l'équivalence : quantité de matière de soude = quantité de matière d'acide
n= 0,100*10,3 =1,03 mmol.
Concentration d'un acide : n / V = 1,03 / 10 = 0,103 mol/L.
c. Le pKa du couple auquel appartient l'acide faible vaut 2,9. Faux.
d.
On dilue deux fois toutes les solutions et on recommence le dosage.
Dans le cas de la solution d'acide faible, le pH du point équivalent
augmente. Faux.
|
| .
. |
|
|
5. Dans un remier temps, on fait agir à chaud 20 mL de soude 1 mol / L sur un comprimé d'aspirine non effervescent.
Dans un deuxième temps on étend la solution à 100 mL. On obtient la solution S.
Dans
un troisième temps on dose en présence de phénolphtaléine 10 mL de la
solution S avec de l'acide chlorhydrique 0,05 mol/L. VE = 17,8 mL.
a.
Le bilan de la réaction du premier temps est mole à mole, c'est à dire
qu'une mole d'aspirine réagit avec une mole de soude. Faux.
On dose la fonction acide carboxylique et on saponifie la fonction ester.
b. Etendre à 100 mL consiste à ajouter de l'eau jusqu'à obtenir une solution dont le volume est égal à 100 mL. Vrai.
c. Dans 100 mL de la solution S, il reste 0,0089 mol d'ion hydroxyde. Vrai.
On titre la soude en excès dans le troisième temps.
A l'équivalence : quantité de matière de soude = quantité de matière d'acide.
n= 0,05*17,8 =0,89 mmol dans 10 mL de solution , soit 8,9 mmol dans 100 mL de S.
d. Sur la boîte d'aspirine on peut lire " aspirine 500". Faux.
Quantité de matière de soude réagissant dans le premier temps : 20-8,9 = 11,1 mmol.
Quantité de matière d'aspirine : 11,1 / 2 =5,55 mmol.
Masse d'aspirine 5,55 M(aspirine) = 5,55 *180 = 999 mg.
6. L'acide acétylsalicylique, AH, peu soluble dans l'eau est la forme liposoluble de l'aspirine tandis que l'ion conjugué, A-, très soluble dans l'eau, en est la forme hydrosoluble. pKa(AH / A-) = 3,8.
Le pH de la muqueuse gastrique est de 1,6 et celui de la muqueuse intestinale est de 8.
Selon
les cas et les besoins, on utilise les différentes formes de l'aspirine
: aspirine simple, aspirine effervescente contenant de
l'hydrogénocarbonate de sodium, aspirine retard.
a. Les espèces prédominantes de l'aspirine sont AH dans l'estomac et A- dans l'intestin. Vrai.
A pH inférieur à pKa, la forme AH prédomine.
b. A la mise en solution d'un comprimé d'aspirine effervescente, il se dégage du dioxyde de carbone. Vrai.
c. Les comprimés d'aspirine retard ne se dissolvent pas dans l'estomac. Vrai.
d.
Pour vérifier qu'un comprimé d'aspirine 500 contient bien 500 mg
d'acide acétylsalicylique, on procède à un dosage : après dissolution
de deux comprimés dans 500 mL d'eau, on prélève 100 mL de solution
obtenue que l'on dose à l'aide d'une solution de soude à 0,1 mol/L en
présence d'un indicateur coloré. Le virage de l'indicateur est tel que VE = 11,1mL. Vrai.
Quantité de matière d'aspirine dans 2 comprimés : 1 / m(aspirine) = 1 /180 ~5,5 10-3 mol.
Soit 5,5 10-3 / 5 = 1,1 10-3 mol dans 100 mL.
Volume de soude ajouté à l'équivalence : 1,1 10-3 / 0,1 = 0,011 L = 11,mL.
|
|
|
|
7. Le sang est coloré en rouge par l'hémoglobine, protéine associée à l'ion Fe2+, qui contient en masse 0,34 % de fer et dont la masse molaire moléculaire vaut environ 66 kg / mol.
Le pH du sang est égulé par le couple CO2 dissous / HCO3-
est voisin de 7,4 mais le sang veineux est plus riche en dioxyde de
carbone que le sang artériel. Le produit ionique de l'eau vaut 10-14 à 25°C et il augmente avec la température.
a. A 37°C le sang est acide. Faux.
Le pHneutre à 37°C est un peu inférieur à 7 et le pH du sang est voisin de 7,4.
b. Le couple CO2 dissous / HCO3- est un tampon biologique. Faux.
c. Le pH du sang veineux est supérieur à celui du sang artériel. Faux.
pH = pKa ( CO2 dissous / HCO3- ) + log ([HCO3- ] /[CO2 dissous]).
Si [CO2 dissous] augmente, le pH diminue.
d. Une molécule d'hémoglobine comporte 4 atomes de fer. Vrai.
66 *0,34 / 100 = 0,224 kg = 224 g de fer dans cette molécule soit 224 / M(fe) = 224 / 56 ~4.
8.
A 25°C, dans un litre d'eau on introduit sans variation de volume 0,005
mol de chlorure d'hydrogène, 0,025 mol d'hydroxyde de sodium et 0,040
mol d'acide salicylique AH. (pKa(AH/A-) =3,0).
a. Après la première réaction prépondérante on a [H3O+]=5 10-13 mol/L. Vrai.
H3O+aq + HO-aq = 2H2O(l).
[H3O+]initial =0,005 mol réagit avec 0,005 mol d'ion hydroxyde. Il reste 0,020 mol d'ion hydroxyde dans 1 L.
[H3O+]final =10-14 /0,02 = 5 10-13 mol/L. pH =14 + log (0,02) = 12,3.
b. Après la seconde réaction prépondérante on a [HO-]=10-11 mol/L. Vrai.
AH aq + HO-aq = H2O(l) +A-aq.
0,02
mol d'ion hydroxyde réagit avec 0,02 mol d'acide salicylique ; il
reste 0,02 mol d'acide salicylique et il s'est formé 0,02 mol d'ion
salicylate.
On a une solution tampon de pH =pKa(AH/A-)=3,0.
c. La solution obtenue est une solution tampon. Vrai.
d. La constante de réaction de la seconde réaction prépondérante est égale à 1011. Vrai.
K = [A-aq] / ([AH aq][HO-aq]) =[A-aq] [H3O+]/ ([AH aq][HO-aq][H3O+]) = Ka / Ke = 10-3 / 10-14 = 1011.
9. On prépare une solution S en mélangeant 10 mL d'acide benzoïque AH 0,05 mol/L et 2,5 mL de soude 0,10 mol/L.
Le pH de la solution est égal à 4,2.
a. pKa(acide benzoïque / ion benzoate) = 4,2. Vrai.
2,5*0,10
= 0,25 mmol de soude réagit avec 0,25 mmol d'acide benzoïque (il en
reste0,05*10-0,25= 0,025 mmol) et il se forme 0,25 mmol d'ion benzoate.
b. L'équation bilan de la réaction de l'acide benzoïque sur la soude s'écrit :
C6H5COOH + NaOH --> C6H5COONa + H2O. Vrai.
c. On dilue 10 fois la solution S. Le pH devient égal à 5,2. Faux.
Le pH d'une solution tampon ne varie pas lors d'une dilution modérée.
d.
On mélange 10 mL d'acide benzoïque 0,05 mol/L et 5 mL de benzoate de
sodium 0,10 mol/L. On obtient une solution dont le pH vaut 4,2.Vrai.
[acide benzoïque]=10*0,05 / 15 mol/L ; [ion benzoate]= 5*0,10 / 15 mol/L.
|
|
|
|