Analyse
spectrale de l'aspirine et dosage conductimétrique ;
concours inspecteur dgccrf 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Spectre
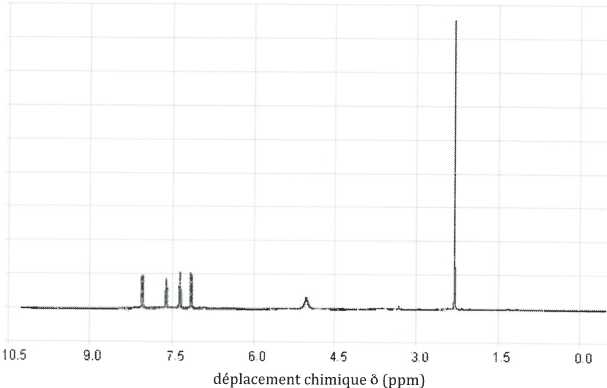
RMN de la molécule d'aspirine.
1.
Recopier la formule de la molécule d'aspirine et identifier les deux
groupes caractéristiques. Les nommer.
Quels sont "ces indices " révélés par la RMN du proton ?
La RMN du proton met en évidence le nombre de groupes de protons équivalents.
L'intégration conduit au nombre de protons dans chaque groupe.
La multiplicité donne le nombre de protons fixés sur les carbones voisins.
Les déplacements chimiques renseignent sur la présence de fonctions organiques.
1.2.
Compléter le tableau suivant :
d (ppm)
|
Multiplicité
du signal
|
Intégration
nombre de protons
|
Identification
des protons
|
Identification
des protons voisins
|
2,35
|
singulet
|
3
|
F
|
aucun
|
7,14
|
doublet
|
1
|
E
|
C
|
| 7,36 |
triplet |
1 |
B |
C et D |
| 7,62 |
triplet |
1 |
C
|
B et E
|
| 8,13 |
doublet |
1 |
D |
B |
| 11 |
singulet |
1 |
A |
aucun |
Le déplacement chimique des protons du benzène vaut 7,3 ppm.
Le groupe COOH est attracteur et déblinde les protons.
Le groupe O-CO-CH3 est faiblement donneur.
Les effets s'exercent sur les sites ortho et plus faiblement en para.
Il s'agit bien du spectre RMN de
l'aspirine.
|
| .
. |
|
|
Spectre
de masse.
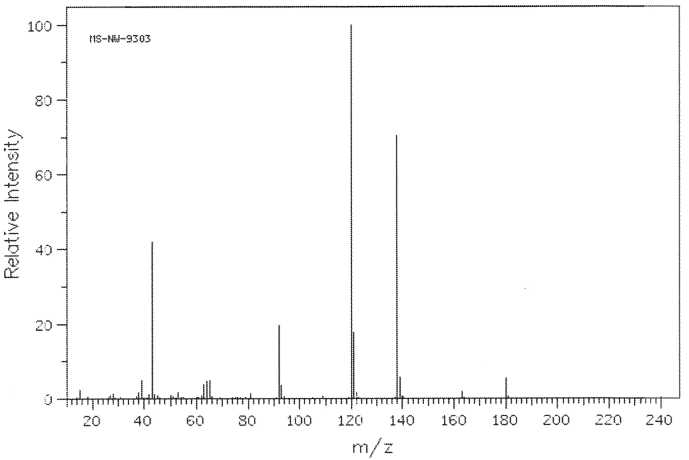
1. Quel est le pic
de base ?
Le pic de base a une intensité
relative égale à 100 : m/z = 120.
2. Quel est le pic
parent ?
Le pic parent ou pic moléculaire se trouve à m / z = 180.
3. Analyser les
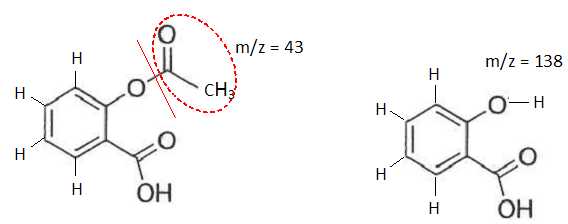
fragments de rapport m/z =138 et m/z = 43.
|
|
|
|
Titrage
conductimétrique de l'aspirine.
L'étiquette d'un sachet d'aspirine porte la mention " teneur en
aspirine 100 mg".
Un technicien va vérifier la teneur en aspirine, notée AH, de ce
sachet. Pour cela, il prépare une solution S en introduisant l'aspirine
contenue dans le sachet dans une fiole jaugée, puis en ajoutant de
l'eau distillée pour obtenir une solution de volume 500,0 mL.
Il prélève ensuite un volume V1 = 100 mL de
cette solution qu'il dose avec une solution aqueuse d'hydroxyde de
sodium de concentration molaire c2 =1,00 10-2
mol/L.
1.
Ecrire l'équation de la réaction acido-basique du dosage.
AH aq + HO-aq ---> A-aq
+ H2O(l).
2. Justifier
l'augmentation brusque de la conductivité après l'équivalence.
Après l'équivalence, l'ion hydroxyde est en excès. On ajoute à la
solution des ions hydroxyde et des ion sodium. La
conductivité molaire ionique de HO- est très
grande par rapport à celles des autres ions présents.
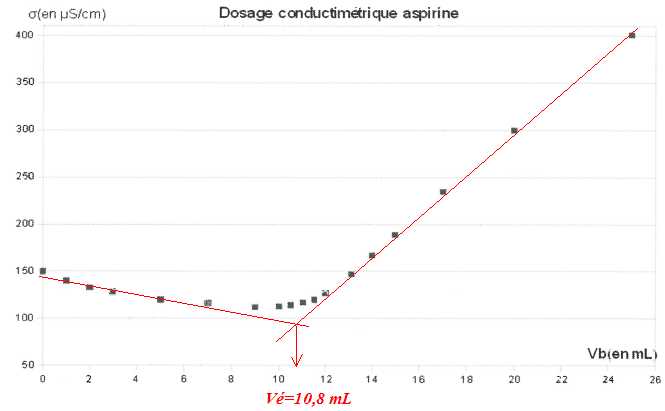
3.
Déterminer graphiquement le volume équivalent Vé et en déduire la
concentration molaire c1 de AH dans la solution
S.
A l'équivalence Vé c2 = V1c1
; c1 =Vé c2 / V1
=10,8 *0,010 / 100 = 1,08 10-3 mol/L.
4.
Déterminer la masse mA
d'aspirine contenue dans le sachet.
5,4
10-4 mol d'aspirine dan 500 mL soit 5,4 10-4
*M(AH) =5,4 10-4 *180 =0,097 g = 97 mg.
5.
On montre que l'incertitude élargie sur la valeur de mA
associée à un niveau de confiance de 95 % est U(m) = 5 mg.
L'encadrement de la masse mA obtenue dans la
question précédente est-il en accord avec la mention portée sur le
sachet d'aspirine ?
Oui. mA ±U(m) = 97 ±5 mg.
100 mg appartient à l'intervalle de confiance [92 mg ; 102 mg ].
|
|
|
|