La tyrosine.
Bas S Antilles 09/2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Etude de la molécule.
1.1. Entourer les groupes caractéristiques présents et justifier la famille de composés à laquelle elle appartient.
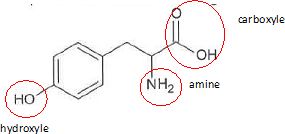
La tyrosine possède une fonction acide carboxylique et une fonction amine portées par le même carbone : c'est un acide a-aminé.
1.2. La L-tyrosine est un stéréoisomère de la tyrosine. Justifier que la molécule de tyrosine possède des stéréoisomères.
La présence d'un atome de carbone asymétrique conduit à l'existence de deux énantiomères.
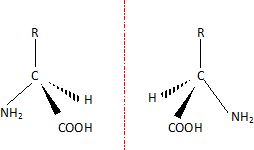
1.3. En utilisant une formule simplifiée de la tyrosine, donner en représentation de Cram les stéréoisomères de la tyrosine.
Etude de la première étape de la synthèse de la L- tyrosine.
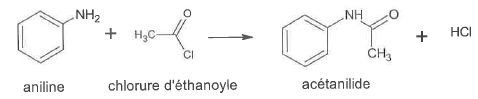
Au laboratoire on fait réagir 10,0 mL d'aniline avec un excès de chlorure d'éthanoyle. On obtient 11,2 g d'acétanilide.
2.1.1. Indiquer la catégorie de la réaction correspondant à la première étape.
Réaction de substitution ( un hydrogène du groupe amine est remplacé par le groupe -COCH3)
2.1.2.
A partir de l'état physique des espèces mises en jeu, proposer une
méthode expérimentale pour récupérer l'acétanilide du milieu
réactionnel.
A température ambiante, sous pression de 1 bar, l'aniline, le chlorure
d'éthanoyle et HCl sont liquides. Seul l'acétanilide est solide. Par
filtration, on récupère l'acétanilide solide.
|
|
|
2.1.3. A l'issue de la première étape, on réalise les spectres IR de l'aniline et du produit obtenu.
Montrer que l'aniline a bien été transformée intégralement en acétanilide.
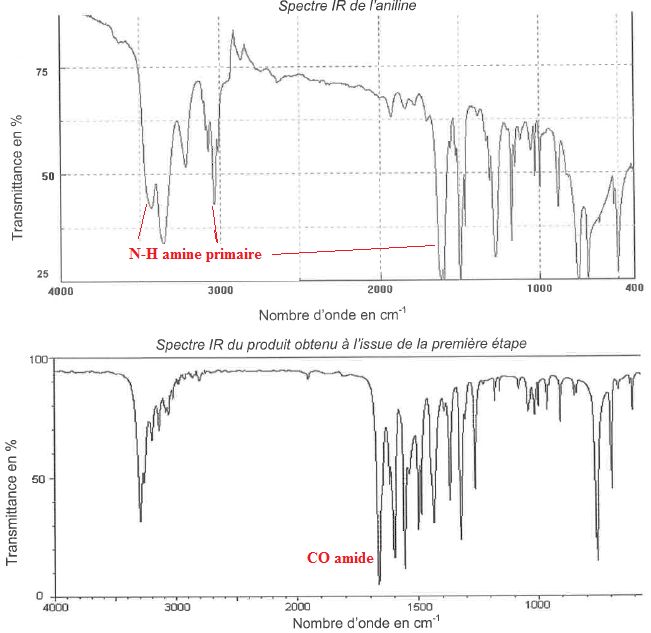
Les bandes caractéristiques du groupe amine primaire ont disparu.
2.1.4.
Montrer que le rendement de cette première étape, noté r, est de
l'ordre de 75 %. Proposer une explication expérimentale pour rendre
compte d'une valeur inférieure à 100%.
Masse volumique de l'aniline : 1,02 g/ mL ; masse d'aniline m = 10,0 * 1,02 =10,2 g.
Masse molaire aniline : M = 93 g/mol ; n(aniline) = m/M = 10,2 / 93 =0,1097 mol.
On peut espérer obtenir au mieux 0,1097 mol d'acétanilide ( M' =135,0 g/mol) soit en masse : 135,0 *0,1097 = 14,8 g.
r = masse expérimentale / masse théorique = 11,2 / 14,8 ~0,76 ( 76 %).
Une partie d'acétanilide est perdue lors de la filtration.
|
|
|
|
2.2.
Repérer et entourer le site donneur et le site accepteur de doublets
d'électrons intervenant dans cette étape. Compléter cette étape par des
flèches courbes. Qu'indiqent ces flèches ?
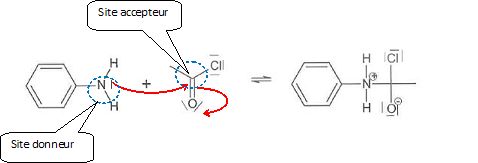
Ces flèches indiquent le mouvement d'un doublet d'électrons.
3. Contrôle de qualité d'une gélule de L-tyrosine.
L'étiquette mentionne : 500 mg de principe actif. On désire vérifier cette information par un dosage spectrophotométrique.
Dissoudre totalement la gélule dans 2,00 L d'eau ( solution S).
Préparer une solution aqueuse de L-tyrosine de concentration c0 = 2,5 10-3 mol/L ( solution S0).
Préparer 4 solutions filles à partir de S0, de concentrations respectives 5,0 10-4 mol/L, 1,0 10-3 mol/L, 1,5 10-3 mol/L et 2,0 10-3 mol/L.
Mesure l'absorbances des solutions filles et de S. L'absorbance de la solution S est égale à 1.
On donne le spectre d'absorption UV d'une solution de L-tyrosine à pH = 7.
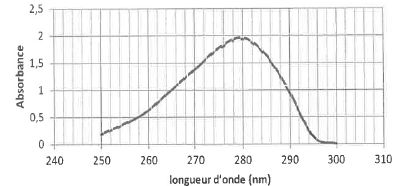
3.1. Quels réglages faut-il effectuer sur le spectrophotomètre pour réaliser ce contrôle qualité ?
Choisir la longueur d'onde de travail correspondant au maximum d'absorption.
Faire le blanc : mesurer l'absorbance d'une solution ne contenant
par la L-tyrosine, correspondant à une absorbance nulle.
3.2. Déterminer le volume de la solution mère à prélever pour préparer 100,0 mL de solution fille S1.
Facteur de dilution : F = 2,5 10-3 /(5,0 10-4) =5.
Prélever 100,0 5 = 20,0 mL de solution mère à l'aide d'une pipette jaugée.
Verser ce prélevement dans une fiole jaugée de 100,0 mL et compléter avec de l'eau distillée jusqu'au trait de jauge.
3.3. La teneur de la gélule est-elle conforme à l'étiquette ?
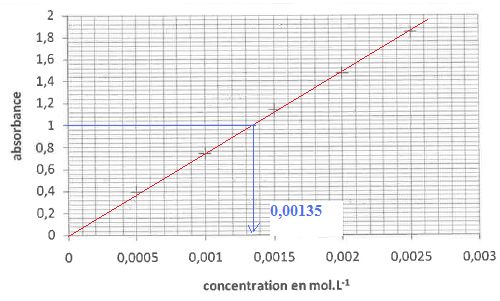
M(L-tyrosine) = 181,0 g/mol.
0,00135*181,0 = 0,244 g / L soit environ 489 mg de L-tyrosine dans 2 L d'eau.
L'indication est correcte ( écart relatif 2,2 %).
4. De la tyrosine à une protéine.
Une première liaison peptidique est créée par réaction de condensation
entre la tyrosine ( TYR) et la glycine ( GLY) afin de donner, dans un
premier temps, un dipeptide ( TYR-GLY).
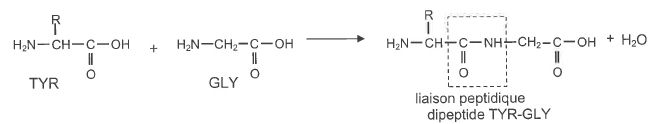
4.1. Sans
précautions particulières prise lors de cette synthèse, combien de
dipeptides différents peut-on obtenir à partir de la tyrosine et de la
glycine ?
La fonction acide carboxylique d'une molécule peut réagir avec la fonction amine d'une autre molécule identique ou différente.
On peut obtenir 4 dipeptides : GLY-GLY ; TYR-TYR ; TYR-GLY et GLY-TYR.
4.2. Proposer une stratégie qui permette de synthétiser uniquement le dipeptide TYR-GLY.
Protéger la fonction acide carboxylique de la glycine et la fonction amine de la tyrosine.
Réaliser la première étape de la synthèse.
Déprotéger les fonctions préalablement citées.
|
|