Des récifs
coralliens artificiels.
Bas S Métropole 09/2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Dans
cet exercice, on se propose d’étudier la reconstitution des récifs
coralliens dans l’île de Bali, grâce à la technique de l’électrolyse. À
Bali, la croissance moyenne du squelette des coraux naturels est de
l’ordre de 2 mm par an. Une équipe de chercheurs souhaite fabriquer un
récif corallien artificiel à Permutaran grâce à la technique « Biorock
».
Ils ont besoin pour cela de déposer du carbonate de calcium sur des structures métalliques..
Le dispositif installé au nord de Bali est réalisé avec des moyens très simples :
- le fer acheté sur les marchés locaux est soudé sur place ;
- des plongeurs attachent des coraux à cette grille avec du fil de fer fin ;
- l’installation est électrifiée sous une tension de 3,0 V et un courant de 10 A.
La cathode est le siège d’une réduction modélisée par la demi-équation suivante :
2 H2O(ℓ) + 2e – = H2(g) + 2 HO –(aq) (1)
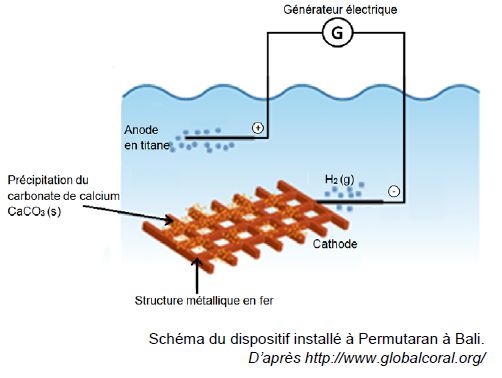
Le dioxyde de carbone CO2 présent dans l’atmosphère et dissous dans l’eau ainsi que les ions Ca2+ présents naturellement dans l’eau de mer réagissent avec les ions HO- produits à la cathode pour former le carbonate de calcium selon la réaction suivante :
Ca2+(aq) + CO2(g) + 2 HO- (aq) --> CaCO3(s) + H2O(ℓ) (2)
On ne tiendra pas compte des réactions de précipitation des autres ions présents dans l’eau de mer.
|
|
|
1. Calculer la quantité de matière d’électrons, en moles, nécessaire à l’obtention d’une masse m = 1,0 g de carbonate de calcium.
M(CaCO3) =100 g / mol.
Quantité de matière de carbonate de calcium : n = 1,0 / 100 = 1,0 10-2 mol.
Quantité de matière d'ion hydroxyde correspondant : d'après (2), n(HO-) = 2 n = 2,0 10-2 mol.
Quantité de matière d'électrons : d'après(1), n(e-) = n(HO-) = 2,0 10-2 mol.
|
|
2.
À partir des documents fournis, calculer la durée d’électrolyse
nécessaire à la réalisation d’un dépôt artificiel de carbonate de
calcium de 2 mm d’épaisseur sur une surface métallique de 4 m2. Commenter la valeur obtenue en admettant que le squelette du corail n’est fait que de carbonate de calcium.
Volume du dépôt : V =2 10-3 *4 = 8 10-3 m3.
Masse volumique du carbonate de calcium : r = 2,9 103 kg m-3.
Masse de carbonate de calcium : m = V r = 8 10-3 * 2,9 103= 23,2 kg.
Quantité de matière correspondante : n = m/M(CaCO3) = 23,2 / 0,100 = 232 mol.
Quantité de matière d'électrons : n(e-) =2 n = 464 mol.
Une mole d’électrons possède une charge électrique égale en valeur absolue à 9,65 × 104 C.
Quantité d'électricité échangée Q =9,65 × 104 n(e-) =9,65 × 104 *464 = 4,478 107 C.
Durée de l'électrolyse : Dt = Q / I = 4,478 107 / 10 = 4,478 106 s.
Soit environ 52 jours.
Cette méthode de reconstitution du corail est très lente. Néanmoins ces
récifs artificiels croissent 5 fois plus vite que les récifs naturels.
De plus, ce dispositif est neutre en CO2, l'électricité nécesaire pouvant être produite par des éoliennes ou des panneaux solaires.
|
|