Les
fruits et la santé : acide base, ester, radioactivité, photon.
Bas ST2S Métropole 09/2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
De la vitamine C dans le jus d'orange.
1. La vitamine C (ou acide ascorbique) est un acide selon Brönsted noté HA. Sa base conjuguée(l’ion ascorbate) sera notée A-.
1.1. Définir un acide de Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un proton H+.
1.2. Le pKa
de ce couple vaut 4,1. Représenter, sur un axe gradué en unité de pH,
le diagramme de prédominance de l’acide ascorbique HA et de l’ion
ascorbate A-.
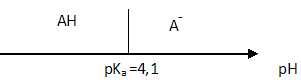
1.3.
Le pH du jus d’orange vaut 3,5. Indiquer l’espèce acido-basique
prédominante présente dans le jus de fruit. Justifier la réponse à
l'aide du diagramme tracé à la question précédente.
A pH inférieur à pKa, la forme acide AH prédomine.
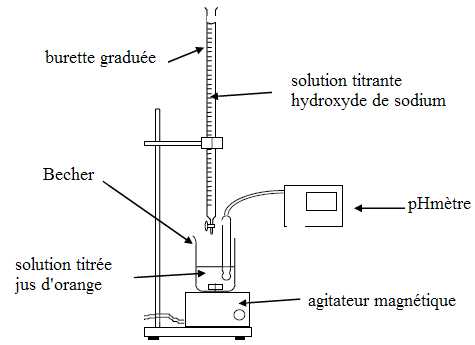
2. On se propose de contrôler la concentration en vitamine C d’un jus d’orange fraîchement pressé grâce à un dosage acido-basique.
Pour cela, on dose un volume Va de jus d’orange à l’aide d’une solution aqueuse basiqued’hydroxyde de sodium (Na+ + HO-) de concentration Cb.
Données : Va = 20,0 mL ; Cb = 6,10 x 10-3 mol.L-1.
2.1. Annoter le schéma du dispositif expérimental du dosage acido-basique.
2.2. On donne les demi-équations associées aux couples acide/base mis en jeu dans ce dosage :
- acide ascorbique HA / ion ascorbate A- : HA / A-
- eau H2O / ion hydroxyde HO- : H2O / HO-.
Écrire l’équation de la réaction de dosage de l’acide ascorbique HA par les ions hydroxyde HO-.
AH + HO- ---> A- + H2O.
2.3. Définir l’équivalence d’un dosage.
A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques.
2.4. À l’aide de la courbe donnée, déterminer le volume Veq
de solution d’hydroxyde de sodium versé à l’équivalence. Justifier
votre réponse en faisant apparaître les traits de construction de la
méthode des tangentes sur la courbe.
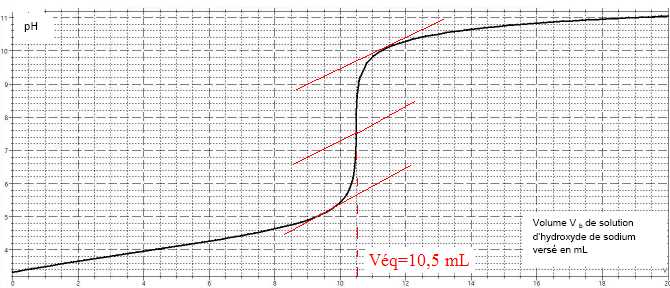
2.5. Montrer que la concentration molaire Ca en acide ascorbique de la solution étudiée est égale à 3,2 x 10-3 mol.L-1. On rappelle la relation vérifiée ici à l’équivalence : Ca x Va = Cb x Veq.
Ca = Cb x Veq / Va =6,10 10-3 *10,5 / 20 = 3,2 x 10-3 mol.L-1.
2.6. Vérifier que la masse molaire de l’acide ascorbique de formule brute C6H8O6 vaut
M = 176 g.mol-1.
M = 6*12 + 8 +6*16 = 176 g.mol-1.2.7. Calculer la masse m d’acide ascorbique dans un volume de 1,0 L de jus d’orange.
m = Ca M = 3,2 10-3*176 = 0,56 g.2.8.
Deux jours plus tard, on réalise un nouveau dosage de ce même jus
d’orange dans des conditions analogues : volume prélevé de jus d’orange
identique et même concentration de la solution d’hydroxyde de sodium.
Le volume de solution d’hydroxyde de sodium à l’équivalence est de 9,3
mL. Expliquer, sans calcul, si cette mesure est cohérente avec les
conclusions des chercheurs de l’université de médecine de Rennes.
La
vitamine C se combine en effet facilement à l’oxygène, passant de sa
forme active (vitamine C réduite) à sa forme inactive (oxydée). A la
lumière du jour à 25°C (température ambiante) et à 4°C (température du
réfrigérateur), si les jus contenaient à l’origine 528 mg de vitamine C
par litre, cette teneur passait en une journée à 510 mg/L (à 25°C ou
4°C), puis à 470 mg/L le deuxième jour.
|
|
|
Arômes de fruits.
Des
arômes naturels de fruits peuvent être ajoutés à certains mets afin
d’en accentuer le goût. Une des molécules présentes dans l’arôme
naturel de pomme est un ester nommé butanoate de méthyle, de formule
semi-développée :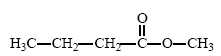
Cette molécule peut être synthétisée au laboratoire à partir des deux molécules A et B suivantes.
1. Entourer et nommer le groupe caractéristique présent dans la molécule A.
2. Nommer la molécule B.
3. Compléter l’équation chimique de la réaction de synthèse du butanoate de méthyle.
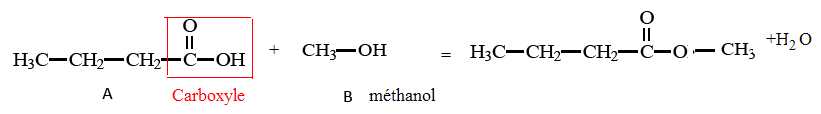
4. Pour réaliser la synthèse du butanoate de méthyle, on utilise le montage suivant :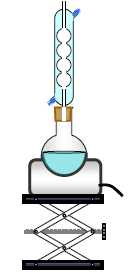
Nommer ce type de montage. Chauffage à reflux.
5. Citer deux caractéristiques de la réaction d’estérification.
Lente et limitée par l'hydrolyse de l'ester.
6. On réalise l’estérification d’un mélange de deux moles de molécules A et deux moles de molécules B.
6.1. Dans l’hypothèse d’une réaction d’estérification totale, donner la quantité de matière maximale d’ester nmax attendue en fin de réaction. Justifier la réponse.
A
partir de 2 moles de A et 2 moles de B, les coefficients
stoechiométriques de l'équation précédente indiquent que l'on peut
obtenir nmax = 2 moles d'ester.
6.2. En réalité, le rendement h de cette estérification est égal à 0,67. Calculer la quantité de matière d’ester nréel réellement obtenue en fin de réaction, à l'équilibre.
nréel = h nmax = 0,67*2 ~1,3 mol.
|
|
|
|
Irradier les fruits pour les conserver.
1. Le diagramme ci-dessous représente les différents domaines d’ondes électromagnétiques en fonction de l (lambda).
Indiquer le nom de la grandeur physique représentée par la lettre
2. Placer, sur le diagramme des domaines d’ondes électromagnétiques, les rayonnements infrarouge, X et ultraviolet.
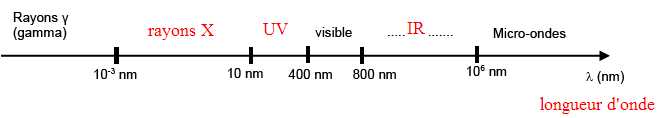
3. L’énergie E d’un photon d'un rayonnement électromagnétique est égale à 2,1 x 10-13 J.
On rappelle la relation existant entre l’énergie E et la grandeur physique l : E = h x c/ l.
Données : h = 6,62 x 10-34 J.s ; c = 3 x 108 m.s-1.
3.1. Indiquer ce que représente la constante c.
c :célérité dela lumière dans le vide.
3.2. Calculer la valeur l de ce rayonnement en m puis en nm. Donnée : 1 nm = 1 x 10-9 m
l = h c / E = 6,62 10-34 *3 108 /(2,1 10-13)=9,5 10-13 m = 9,5 10-4 nm ( domaine des rayons g).
3.3.
Indiquer si ce rayonnement peut être utilisé pour l'irradiation des
fruits dans le but de les conserver plus longtemps. Justifier la
réponse.
La radioactivité est utilisée pour éliminer à froid les
micro-organismes, bactéries, moisissures, parasites. Par exemple les
fraises sont irradiées par des rayons g. Le rayonnement précédent peut convenir.
4.
L’irradiation des aliments frais, qui permet de détruire des bactéries,
se fait avec des isotopes radioactifs tels que le cobalt 60.
4.1. Définir le terme « isotope ».
Deux isotopes ne différent que par leur nombre de neutrons. Ils ont le même numéro atomique Z.
4.2. Donner la composition du noyau de cobalt 60 de symbole 6027Co.
27 protons et 60-27 = 33 neutrons.
4.3. L’équation de désintégration du cobalt 60 s’écrit :6027Co --> AZY* +0-1e.
4.3.1. Indiquer à quel type de radioactivité correspond cette désintégration.
Emission d'un électron, donc radioactivité de type ß-.
4.3.2. Identifier le noyau fils parmi les noyaux suivants : 6026Fe* ; 5927Co* ; 6028Ni* . Justifier votre choix.
Conservation du nombre de nucléons : 60 = A +0, d'où A = 60.
Conservation de la charge : 27 = Z-1 d'où Z = 28.
6027Co --> 6028Ni* +0-1e.
4.4. Citer deux moyens de radioprotection du personnel utilisés lors du traitement des fruits.
Boucliers
en béton, boucliers mobiles, immersion de la source radioactive pour
permettre la maintenance ; les produits à irradiés sont placés sous des
cloches hermétiques..
4.5. Indiquer pourquoi cette méthode de conservation des aliments est source de controverse pour le grand public.
Les
aliments irradiés ne deviennent pas radioactifs, mais certaines
vitamines peuvent être détruites et certaines qualités gustatives
altérées.
|
|