Synthèse d'un
médicament. Bac S Amérique du Sud 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
Le
benzaldéhyde est un liquide incolore, couramment utilisé comme additif
alimentaire pour son odeur d’amande amère. Il s’avère également être
d’une grande utilité en chimie organique de synthèse ; cet exercice
cherche à étudier quelques aspects de la synthèse d’une molécule
d’intérêt biologique, la sertraline (antidépresseur), à partir du
benzaldéhyde.
Une voie de synthèse propose de synthétiser, en 9 étapes, la sertraline
à partir du benzaldéhyde.
Partie 1 : pureté du benzaldéhyde.
Le benzaldéhyde étant susceptible de s’oxyder en acide benzoïque
lorsque le flacon est entamé, il convient de vérifier sa pureté avant
de l’utiliser comme réactif.
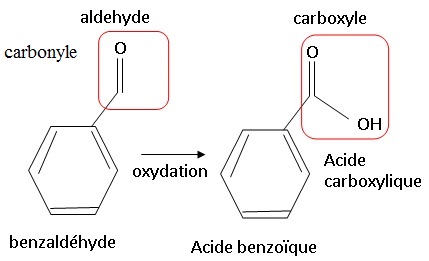
1.1. Sur les
molécules de benzaldéhyde et d’acide benzoïque, entourer les groupes
caractéristiques et nommer les fonctions correspondantes.
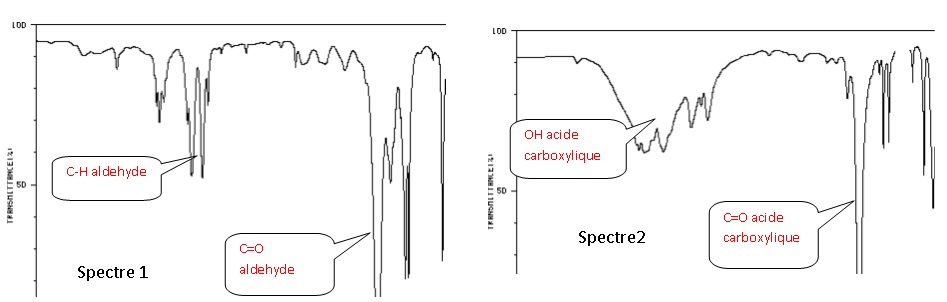
1.2. En expliquant la démarche suivie, associer à chaque molécule (benzaldéhyde et acide
benzoïque) un des spectres infrarouge reproduits ci-dessous.
Pour
vérifier la pureté du benzaldéhyde qu’il va utiliser pour une synthèse,
un élève réalise dans son lycée la chromatographie sur couche mince
(CCM) de la solution contenue dans un flacon entamé de benzaldéhyde. Il
obtient le chromatogramme ci-contre, où B correspond au point de dépôt
de la solution contenue dans le flacon de benzaldéhyde et AB correspond
au point de dépôt d’acide benzoïque.
1.3. Expliquer ce que la CCM permet de conclure.

L'acide benzoïque AB sert d'étalon. Le contenu du flacon B
contient deux espèces, l'acide benzoïque et le benzaldehyde. Le
benzaldehyde est en partie oxydé en acide benzoïque.
|
|
|
L’élève
cherche à déterminer quantitativement la pureté du benzaldéhyde dans le
flacon entamé. Pour cela, il réalise le titrage de 10,0 mL de solution
prélevée dans le flacon de benzaldéhyde par une solution aqueuse
d’hydroxyde de sodium, (Na+(aq) + HO-(aq)), de concentration molaire 1,00 mol.L-1.
1.4. Citer la définition d’un couple acide-base et d’une réaction acido-basique.
Un couple acide base noté AH / A- est constitué de deux espèces telles que AHaq = A-aq + H+aq.
AH est l'acide conjugué de la base A-. A- est la base conjuguée de l'acide AH.
Dans une réaction acido-basique, il y a échange de proton entre l'acide
d'un couple acide/base et la base d'un autre couple acide/ base.
1.5. Écrire l’équation de la réaction support de titrage entre l’acide benzoïque et les ions hydroxyde.
On note AH l'acide benzoïque et A- l'ion benzoate. Couples acide /base mis en jeu : AH / A- et H2O / HO-.
AH aq + HO-aq --> A- aq + H2O(l).
Le titrage étant suivi par pHmétrie, l’élève a tracé la courbe pH =
f(V) et la courbe « dérivée de pH » (notée dpH/dV) en fonction de V.
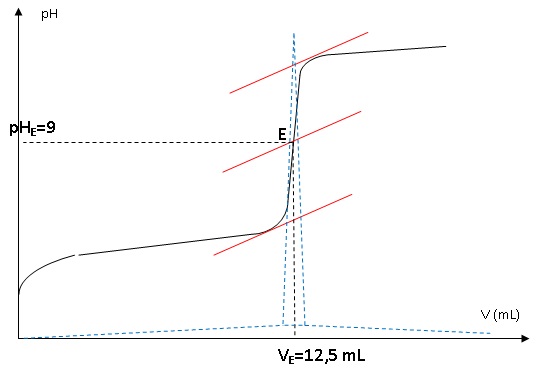
1.6.
Déterminer la quantité de matière d’acide benzoïque présente dans le
volume de solution prélevée en explicitant la méthode utilisée.
A l'équivalence CaVa = Cb VE ; Ca Va = 1,00 x 12,5 10-3 = 1,25 10-2 mol.
1.7. Déterminer la quantité de matière de benzaldéhyde présente dans 10,0 mL de benzaldéhyde pur.
Benzaldéhyde : masse molaire moléculaire : M = 106 g.mol-1 ; masse volumique : ρ = 1,05 g.mL-1.
10,0 x 1,05 / 106 =0,099 mol.
1.8. En déduire la valeur de la pureté de la solution du flacon entamé de benzaldéhyde.
Proportion d'acide benzoïque dans le flacon : 1,25 10-2 / 0,099 = 0,126 ; pureté de la solution : 1-0,126 = 0,874.
1.9. Expliquer quel
indicateur coloré choisir si l’on souhaitait effectuer le même titrage
à l’aide d’un suivi colorimétrique. Indiquer le changement de couleur
qui permettrait alors de repérer l’équivalence.
Le domaine de virage de l'indicateur coloré doit contenir le pH du point équivalent, c'est à dire 9. Le bleu de thymol convient.
Avant l'équivalence, la solution est acide ( la forme acide de
l'indicateur est jaune) ; après l'équivalence la solution a un pH
supérieur à 9 ( la forme base de l'indicateur est bleue).
|
Partie 3 : Variantes proposées pour deux étapes de la synthèse.
Pour réaliser la première étape, une variante présentée ci-dessous peut être envisagée.
Cette variante fait intervenir la réaction de Barbier qui utilise du zinc :
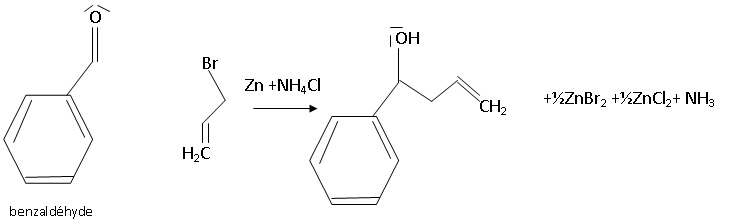
L’avantage de la réaction de Barbier résulte du fait qu’il s’agit d’une
réaction « one pot », c’est-à-dire que tous les réactifs sont mélangés
au départ dans le milieu réactionnel (à t = 0
min). On peut suivre la cinétique de la réaction par CCM, en prélevant
toutes les minutes 1 mL environ du milieu réactionnel et en réalisant
une extraction de la phase organique avec un peu d’éther.
Les CCM ci-dessous ont été obtenues en réalisant des dépôts de la phase
organique à différentes dates de prélèvement (de t = 0 à 7 minutes) et
une révélation sous UV.
3.1. Évaluer la durée de la réaction en expliquant le raisonnement.
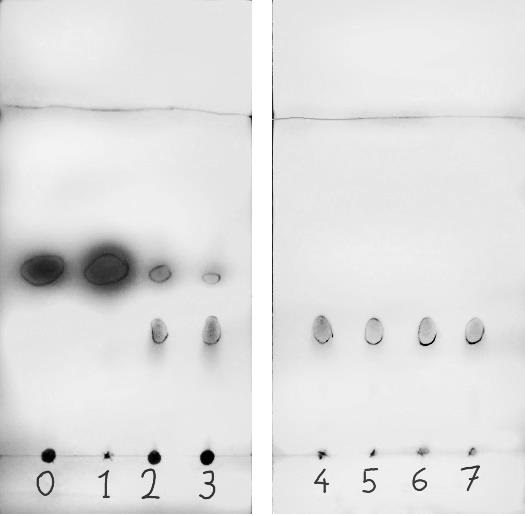
Initialement ( t=0), la révélation aux UV met en évidence uniquement le
benzaldehyde. A partir de t = 2 min, cette révélation met en évidence
le benzaldehyde ( tache plus petite du fait de sa disparition
partielle) un autre produit issu de l'étape 1. A partir de t = 4
min, la tache du benzaldehyde a disparu et la tache relative au produit
de cette étape est présente ( sa dimension ne change plus). Le
benzaldehyde est entièrement consommé au bout de 4 minutes.
Variante de l’étape 7.
L’étape 7 de la synthèse de la sertraline correspond à une oxydation de
Jones, pour laquelle l’oxydant est de l’acide chromique ; le rendement
est de 98 %.
Une variante dite « verte » peut être envisagée, en utilisant une solution à 30 % de peroxyde d’hydrogène H2O2 (couplée à un catalyseur).
3.2. Écrire la
réaction d’oxydo-réduction mise en jeu dans la variante, l’eau oxygénée
étant transformée en eau. Montrer qu’il s’agit d’une oxydation pour
l’espèce organique.
Oxydation ( perte d'électrons) : H3C-(CH2)8-CH2OH +H2O = H3C-(CH2)8-COOH + 4H+ + 4e-.
Réduction de l'eau oxxygénée : 2H2O2 + 4e- +4H+ = 4H2O.
Ajouter : H3C-(CH2)8-CH2OH +H2O +2H2O2 + 4e- +4H+ = H3C-(CH2)8-COOH + 4H+ + 4e-+ 4H2O.
Simplifier : H3C-(CH2)8-CH2OH +2H2O2 = H3C-(CH2)8-COOH + 3H2O.
3.3. Déterminer le
rendement de l’oxydation dans la variante verte, l’eau oxygénée étant
introduite en excès. Peut-on apporter une conclusion quant à l’intérêt
de la variante verte en
termes de rendement ?
Masse du réactif C10H22O introduit : m = 100 g ; masse molaire M = 158 g/mol. Quantité de matière n = 100 / 158 = 0,633 mol.
On peut obtenir au mieux 0,633 mol de produit C10H20O2 ( M =172 g/mol) soit une masse de : 172 x 0,633 ~109 g.
Or on en obtient seulement 96 g : rendement 96 / 109 ~ 88 %.
Le rendement de la variante verte n'est inférieureque de 8 % par rapport à l'oxydation de Jones.
3.4. Donner un
argument qui explique pourquoi cette variante verte est plus compatible
avec la notion de chimie durable que l’oxydation de Jones.
L'oxydation de Jones met en oeuvre un oxydant comtenant du chrome à l'état d'oxydation +VI, métal lourd cancèrigène.
La variante verte met en oeuvre l'eau oxygénée ( provoquant une
irritation de la peau pour une teneur à 30 %) ; ce qui est bien
plus respectueux de l'environnement..
|
|