Synthèse de
l'ammoniac.
Bts Cira 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Synthèse de l'ammoniac.
La synthèse est une transformation limitée dont l'équilibre chimique a pour équation :
N2(g) + 3H2(g) = 2NH3(g).
Q1. Donner l’expression de l’enthalpie standard DrH°
de la réaction de synthèse de l’ammoniac à 298 K en fonction des
enthalpies standards de formation des constituants. Faire l’application
numérique.
DrH° = 2 DfH°(NH3) - 3 DfH°(H2) - DfH°(N2) = 2(-45,9 ) = -91,8 kJ mol-1.
Q2. Donner la signification du signe obtenu pour DrH° ?
DrH° est négatif, la réaction est exothermique.
Q3.
Exprimer la constante d’équilibre K° de la synthèse de l’ammoniac en
fonction des pressions partielles des différents constituants.
K° = P2NH3 / (P3H2 PN2).
Q4. On donne
ci-après un tableau indiquant la valeur de K° en fonction de la
température. Faut-il travailler à haute ou basse température pour
obtenir un rendement élevé en ammoniac ? Justifier la réponse.
| T(°C) |
25
|
200 |
400 |
600 |
K°
|
4,1 108
|
440
|
0,41
|
9,5 10-3
|
K° est d'autant plus grand que la température est plus faible. En travaillant à basse température le rendement sera plus élevé.
Q5. Quelle est l’incidence, du point de vue cinétique, du choix proposé à la question précédente ?
A basse température, on atteint plus lentement l'équilibre.
Q6. Comment remédie-t-on à ce problème dans le procédé Haber-Bosch ?
On utilise un catalyseur, on travaille vers 450°C et on retire
régulièrement de l'ammoniac afin de déplacer l'équilibre vers la droite.
Q7. Quelle est l’influence d’une augmentation de pression, à température constante, sur le rendement de la synthèse ? Justifier.
Une augmentation de pression à température constante, déplace l'équilibre vers la droite ( diminution du nombre de molécules ).
Une fuite a lieu dans une pièce de stockage contenant une bonbonne d’ammoniac gazeux. Le débit de la fuite est de 37,5 mL.h-1.
Au moment de la détection de la fuite et de l’intervention pour la
réparer, on estime qu’il s’est écoulé 24 h pendant lesquelles de
l’ammoniac gazeux s’est dégagé. Les dimensions de la pièce de stockage
sont les suivantes :
- longueur : 4 m
- largeur : 3 m
- hauteur sous plafond : 2,5 m
Q8. Y-a-t-il un danger pour le technicien de maintenance chargé de la réparation ? Justifier par un calcul.
Volume d'ammoniac dégagé : 37,5 *24 = 900 mL.
Volume de la pièce : 4*3*2,5 =30 m3.
Concentration de l'ammoniac dans la pièce : 900 / 30 = 30 ppm.
Au bout de 10 minutes, le technicien perçoit l'odeur de l'ammoniac. Il n'y a pas de danger.
|
|
|
Obtention du dihydrogène.
La
plus grande partie du dihydrogène nécessaire pour la synthèse de
l’ammoniac est produite par vaporeformage du méthane, de formule CH4
et appelé couramment gaz naturel. L’utilisation d’un catalyseur au
nickel est nécessaire. La fabrication de l’ammoniac consomme de 3 à 5 %
de la production mondiale de gaz naturel. L’équation de la réaction du
vaporeformage du méthane est donnée ci-dessous :
CH4(g) + H2O(g) = CO(g) + 3 H2(g) DrH° = 209 kJ.mol-1.
Le volume molaire de gaz sera pris égal à 24,4 L.mol-1. Masses molaires .
Q9. Montrer que l’énergie thermique nécessaire pour produire 1 m3 de dihydrogène par la réaction de reformage vaut Qh = 2,86 x 106 J.
Quantité de matière de dihydrogène : n = 1000 / 24,4 = 40,98 ~41 mol.
Qh = 209*41 / 3= 2,86 103 kJ = 2,86 106 J.
Q10. L’énergie
nécessaire à la réaction de vaporeformage est généralement fournie par
combustion d'une partie du méthane. Écrire l’équation de combustion
complète du méthane, les réactifs et produits étant tous à l’état
gazeux.
CH4(g) + 2O2(g)--> CO2(g) + 2H2O(g).
Q11. Déterminer la quantité de matière de méthane consacrée à la combustion, nécessaire pour fabriquer 1 m3 de dihydrogène par vaporeformage sachant que l’enthalpie standard de combustion du méthane vaut DcH°(CH4) = - 890 kJ.mol-1 (on fera l’approximation que cette enthalpie de réaction ne dépend pas de la température).
2,86 106 / (890 103) =3,2 mol.
Le monoxyde de carbone produit par le reformage est un poison pour le
catalyseur. Il faut donc l’oxyder intégralement en dioxyde de carbone
au fur et à mesure de sa formation.
Q12. Pour 1 m3 de dihydrogène produit, quelle masse de monoxyde de carbone doit être oxydée ?
n(CO) = n(CH4)=n(H2) / 3 = 41 / 3 ~13,7 mol.
M(CO) = 12+16 = 28 g/mol ; m(CO) = 28*13,7~384 g.
|
|
|
|
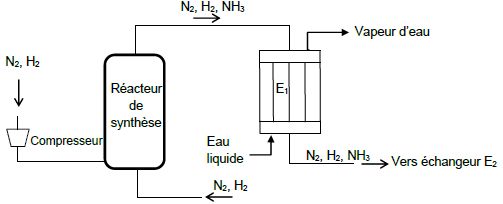
Refroidissement du mélange gazeux à la sortie du réacteur de synthèse.
Un mélange gazeux de dihydrogène et de diazote dans les conditions
stoechiométriques est comprimé à une pression de 150 bar et alimente le
réacteur de synthèse.
La réaction se produit et la température du milieu réactionnel s’élève
à 500 °C. À la sortie du réacteur, le mélange gazeux est alors refroidi
à 400 °C dans un échangeur multitubulaire E1 avec production de vapeur d’eau à haute pression. L'ammoniac est ensuite liquéfié dans un échangeur E2
à basse température et séparé des gaz qui n'ont pas réagi. Les gaz
restants sont en partie recyclés en étant renvoyés à l'alimentation du
réacteur de synthèse.
Dans l’échangeur E1, l’eau liquide pénètre à 250 °C sous 40 bar et est transformée en vapeur à 250 °C et 40 bar en sortie.
La température d’entrée du mélange gazeux dans l’échangeur E1 est prise égale à 500 °C.
L’échangeur est alimenté avec un débit molaire de 1,11 x 107 mol.h-1 du mélange gazeux (N2, H2, NH3).
Ci-dessous, on donne un schéma simplifié de la partie de l’unité de synthèse de l’ammoniac décrite :
Données :
Capacité thermique molaire moyenne des réactifs : Cp = 29,5 J.mol-1.K-1
Chaleur latente de vaporisation de l’eau à 250 °C et 40 bar : Lv = 1 715 kJ.kg-1.
Q13. Calculer le débit d’entrée du mélange gazeux, qn(gaz), dans l’échangeur E1 en l’exprimant en mol.s-1.
1,11 x 107 mol.h-1 = 1,11 107 /3600 = 3,083 103 ~3,08 103 mol s-1.
Q14. Préciser le mode de circulation, co-courant ou contre-courant, dans cet échangeur.
L'eau liquide injecté circule en sens contraire du mélange gazeux (N2, H2, NH3) : mode de circulation contre-courant.
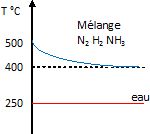
Q15. Donner l’allure des profils de température des fluides impliqués dans l’échange thermique.
Q16. Calculer le flux thermique (ou puissance thermique) échangé lors du refroidissement du mélange gazeux, noté FG.
FG = Cp qn(gaz) Dq = 29,5 *3,08 103 *(500-400)~9,1 106 W.
Q17. Trouver l’expression du flux thermique échangé lors de la vaporisation de l’eau, Fvap, en fonction du débit massique qm(vap) de vapeur d’eau produite à 250 °C.
Fvap = Lv qm(vap).
Q18. En admettant que l’échangeur est parfaitement calorifugé, déterminer la valeur de qm(vap).
FG =Fvap ; Lv qm(vap) = 9,1 106 ; qm(vap) = 9,1 106 / (1,715 106) =5,3 kg s-1.
|
| Acheminement de l’ammoniac liquide pour transformation en nitrate d’ammonium.
L’ammoniac
liquide est acheminé par wagons citernes sur un site de production de
nitrate d’ammonium, principal constituant des engrais. Le transfert
entre le wagon citerne et la sphère de stockage est réalisé par
gravité. Puis une pompe centrifuge permet d’amener l’ammoniac de la
sphère vers un réservoir dont le niveau est supposé constant. La
pression à l’intérieur de la sphère et du réservoir est maintenue à 10
bar et la température à 293 K. L’ammoniac subit ensuite une détente et
un chauffage pour pénétrer, à 6 bar et 160 °C, à l’état gazeux, dans le
réacteur de synthèse du nitrate d’ammonium, en même temps que de
l’acide nitrique.
On limitera l’étude à la portion de l’installation
située entre la sphère de stockage de l’ammoniac liquide (point A) et
le réservoir (point B). Sur cette portion, les canalisations, de
diamètre constant égal à 25 mm, ont une longueur totale de 12,0 m. La
différence de hauteur entre le pied de la sphère et l’entrée dans le
réservoir est de 3,5 m. La longueur équivalente due aux pertes de
charge singulières est de 8,0 m de canalisation droite. Les pertes de
charge unitaires sont égales à 0,05 mètre de colonne de liquide par
mètre de canalisation droite et notées J.
Le débit massique d’ammoniac vaut qm(NH3) = 10,0 t h-1.
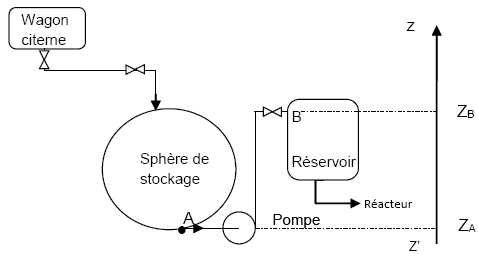
Données :
Masse volumique de l’ammoniac liquide à 10 bar et 293 K : r = 600 kg.-3.
Intensité de la pesanteur : g = 9,8 N kg-1.
Relation de Bernoulli : PA / (r.g)+VA2/(2g)+ zA+Hmt = PB / (r.g)+VB2/(2g)+ zB+Dhc.
Q19. Justifier le choix d’une pression de 10 bar pour le stockage de l’ammoniac liquide à 293 K.
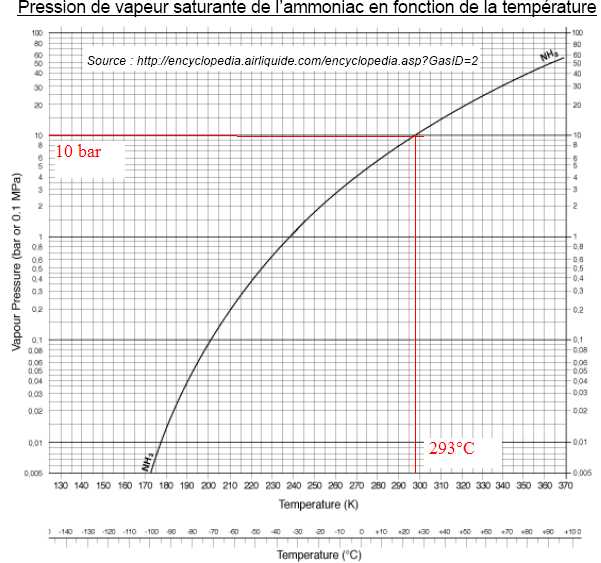
A tempérture ambiante, l'ammoniac est liquide sous une pression de 10 bar.
Q20. Calculer le débit volumique d’ammoniac dans la canalisation, qv(NH3), en m3.s-1.
qm(NH3) = 10,0 t h-1 = 10 103 /3600 = 2,78 kg s-1.
Débit volumique qv(NH3)= qm(NH3) / r = 2,78 / 600 =4,63 10-3 m3 s-1.
Q21. Calculer, entre les points A et B, la vitesse v(NH3) de circulation de l’ammoniac liquide dans la canalisation.
Section de la canalisation S = pD2/4 = 3,14 *(25 10-3)2 /4 = 4,9 10-4 m2.
v(NH3) = qv(NH3) / S = 4,63 10-3 / (4,9 10-4) ~ 9,5 m s-1.
Q22. Calculer les pertes de charge totales Dhc sur cette portion d’installation exprimées en mètres de colonne de liquide.
Dhc = pertes de charge singulière + perte de charge unitaire = 8,0 +12*0,05 = 8,6 m.
Q23. En appliquant le théorème de Bernoulli entre les points A et B, déterminer la hauteur manométrique totale de la pompe, notée Hmt.
Hmt = PB / (r.g)+VB2/(2g)+ zB+Dhc -(PA / (r.g)+VA2/(2g)+ zA).
PA = PB ; Hmt = VB2/(2g)+ zB+Dhc -(VA2/(2g)+ zA).
VA = VB : conservation du débit volumique ( diamètre de la canalisation constant ).
Hmt = zB+Dhc - zA = 3,5 +8,6 = 12,1 m ou rgHmt =600*9,8*12,1 =7,1 104 Pa.
Q24. En déduire la puissance utile de la pompe, notée Pu.
Pu = Hmt qv(NH3)=7,1 104 * 4,63 10-3=3,3 102 W.
Q25. Sachant que le rendement de la pompe vaut 55 %, en déduire la puissance électrique absorbée par celle-ci, Pabs.
Pabs = Pu / 0,55 =3,3 102 / 0,55 ~6,0 102 W.
.
|
|