Centrale
en traitement d'air. BTS FED
2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
La centrale de traitement de l'air assure les fonctions suivantes : préparation et distribution d'air à des caractéristiques thermiques et aérauliques bien définies ; distribution de l'air traité dans les locaux à climatiser par l'intermédiaire de conduits et d'appareils terminaux. A. Mesure du débit volumique du système de ventilation. On
se propose d'étudier le principe de fonctionnement d'une sonde dans le
cas d'un écoulement d'air. On suppose que l'air est incompressible et
que l'écoulement est permanent dans une canalisation horizontale.
1. Proposer une stratégie expérimentale pour mesurer le débit volumique d'air. 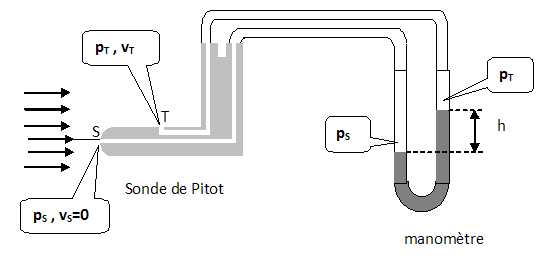 Une
sonde de Pitot est reliée au manomètre à eau, puis introduite dans un
tuyau de soufflage, le ventilateur étant en marche. A partir de la
dénivellation du manomètre, on en déduit la vitesse du fluide.
Connaissant la section du tuyau de soufflage et la vitesse, on en
déduit le débit volumique.
2. On note ra la masse volumique de l'air et v T la vitesse de l'air au point T. Montrer que : p S = ½ rav 2T +p T. Relation de Bernoulli entre T et S : ½ v 2T /g + p T / ( rag) +z T = ½ v2S /g + pS / (rag) +zS. ½ v2T /g + pT / (rag) = pS / (rag).
pS =½rav2T +pT soit pS-pT =½rav2T.3. En appliquant la loi de l'hydrostatique au niveau du manomètre à eau, montrer que la vitesse de l'air va vérifie v a = [2 rgh / ra] ½ avec r masse volumique de l'eau. p S-p T = rgh =½rav2a, par suite : va = [2rgh / ra]½.4. On lit h = 1,70 cm.
4.1. Calculer la vitesse de l'air va. ra = 1,29 kg m-3 ; r = 1,00 10-3 kg m-3 ; g = 9,81 m s-2.
va = [2*1,00 103 *9,81 *1,70 10-2 / 1,29 )]½ =16,1 m /s.
4.2 Montrer que le débit volumique qv vaut environ 9,20 103 m3 h-1.
Diamètre du tube de PVC d = 45,0 cm.
Section interne du tube : S = pd2/4
= 3,14 *0,452 /4 = 0,159 m2.
qv = va S =16,1 *0,159 = 2,56 m3 s-1 soit 2,56*3600 = 9,20 103 m3 h-1.
5. Un moteur de puissance
nominale 11,0 kW a été livré pour le système de conditionnement d'air.
Rédiger une note de service argumentée à l'intention du chef de chantier
pour montrer que ce moteur ne convient pas et proposer un moteur adapté. Le débit horaire de 9,20 10 3 m 3 h -1
peut être obtenu à l'aide d'un moteur de puissance nominale égale à 4
kW. Un moteur de puissance nominale 11 kW ne convient pas.
|
|
|
B. Régulation de la vitesse du moteur.
I.
Les enroulements du stator du moteur asynchrone triphasé sont couplés
en étoile. Les conditions nominales de fonctionnement sont : cos f = 0,79 ; 50 Hz ; D 230 V 15,2 A / 8,8 A ;
Y 400 V 740 tr /min.
Le moteur asynchrone triphasé est alimenté par un réseau triphasé 230 V / 400 V - 50 Hz.
1. Justifier le couplage étoile des enroulements du moteur.
La tension aux bornes de chaque enroulement doit ête égale à 230 V. Seul le montage étoile convient.
2. La puissance nominale Pa absorbée par ce moteur est égale à 4,8 kW.
Calculer la puissance utile Pu
fournie à l'arbre moteur sachant que le rendement est égal à 83 %.
Vérifier que la valeur est cohérente avec le choix précédent du
technicien.
Pu = 0,83 *4,8 ~4,0 kW, en accord avec le résultat ci-dessus.
3. Compléter le document en ajoutant les appareils nécessaires pour mesurer la puissance consommée ainsi que la tension composée.
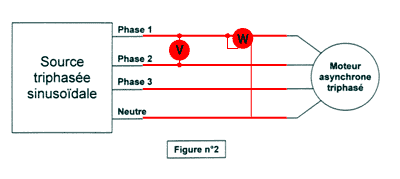
Il faudra multiplier par trois la valeur lue sur le wattmètre.
II. On alimente le moteur à l'aide d'un variateur constitué entre autres d'un onduleur.
1. Indiquer le type de conversion réalisée par l'onduleur.
Conversion courant continu / courant alternatif.
2. Expliquer l'influence de l'onduleur sur la vitesse du moteur et donc sur le débit d'air de la CTA.
L'onduleur
permet de régler la puisance délivrée au moteur. Le ventilateur étant
commandé par le moteur, le débit de l'air de la CTA est donc réglable.
|
|
|
|
Partie C. Choix du combustible de la chaudière, d'un point de vue expérimental.
Une chaudière à gaz peut être alimentée par le butane C4H10 ou le gaz naturel ( constitué essentiellement de méthane CH4 ).
L'énergie
nécessaire pour chauffer 900 L d'eau de 15,0°C à 60,0°C résulte de la
combustion de 3,36 kg de méthane ou de 3,75 kg de butane.
1. Justifier qu'il est nécessaire de déterminer la quantité de CO2 produite par la combustion du méthane ou du butane pour identifier le combustible le plus respectueux de l'environnement.
Le CO2
est un gaz à effet de serre, responsable du réchauffement de la
planète. Il faut donc déterminer les quantités de matière de dioxyde de
carbone résultant de la combustion de 3,36 kg de méthane ou de
3,75 kg de butane.
2. Ecrire
et équilibrer l'équation de la combustion complète du méthane et
déterminer la quantité de matière de dioxyde de carbone produite.
CH4(g) + 2O2(g) --> CO2(g) +2H2O(g).
n(méthane) = m (méthane) / M(méthane) = 3,36 103 / 16,0 = 210 mol.
3.
Sachant que la combustion de 3,75 kg de butane libère 259 moles de
dioxyde de carbone, identifier le combustible le plus respectueux de
l'environnement.
Pour chauffer le même volume d'eau, le méthane
libère moins de dioxyde de cabone que le butane. Le méthane est plus
respectueux de l'environnement.
D. Régulation de la température.
Des
sondes de température d'ambiance sont installées dans les locaux. Le
capteur de température de ces sondes est une PT100, c'est une
résistance dont la valeur varie avec la température.
1. Elaborer un protocole expérimental pour tracer la caractéristique de transfert de cette sonde.
La
résistance de la sonde est mesurée à l'aide d'un ohmètre. On mesure
simultanément la température du bain thermostaté dans lequel plonge la
sonde.
2. Le traitement des résultats à l'aide d'un tableur permet d'obtenir la caractéristique R = 0,389 q +100,3 avec R en ohms et q en °C.
Calculer la valeur de la résistance R1 pour une tmpérature de 21,5 °C.
R1 = 0,389 *21,5 +100,3 = 108,7 ohms.
3.
Lors d'une variation brusque de la température extérieure, l'équilibre
thermique n'est pas atteint immédiatemment. Pour évaluer le temps de
réponse du capteur, on le soumet à un échelon de température et on
enregistre les variations de sa température q en fonction du temps t.
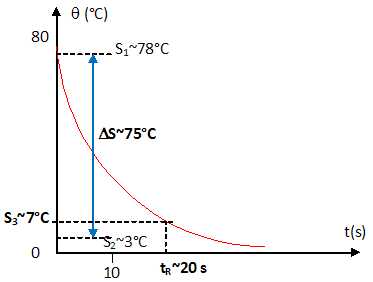
A partir de la courbe ci-dessous, vérifier que le temps de réponse à 5% du capteur est voisin de 20 s.
Température initiale S1 ~78°C ; température finale S2 =~3°C. DS = |S2-S1| ~75°C.
Ajoutons à S2, 5 % de DS pour obtenir S3 : S3 = 3 +0,05*75 ~ 7°C.
Cette
valeur est-elle compatible avec l'utilisation de ce capteur pour une
sonde de température d'ambiance associée à la CTA ? Justifier.
Une température d'ambiance évolue lentement sur plusieurs dizaines de minutes. Ce temps de réponse est donc compatible. |
|
|
Capacité calorifique massique du propylène glycol.
On
utilise de l'eau glycolée pour alimenter le circuit de la batterie
froide de la cenntrale. On souhaite évaluer l'effet de l'ajout de
propylène glycol dans le circuit d'eau sur les transferts de chaleur.
On donne la capacité thermique du calorimètre Ccal = 64 J K-1.
On
transfert une quantité de chaleur que l'on peut déterminer,à une masse
m = 200 g de propylène glycol pris à une température ambiante de 20,0°C
pendant une durée de 8 minutes et on relève la température du liquide
toutes les 30 secondes et ce pendant 9 minutes.
1. Ecrire le protocole expérimental à suivre pour réaliser l'expérience.
Introduire
le liquide dans le vase Dewar, introduire l'agitateur, le thermomètre
et la résistance électrique ; fermer le vase et attendre l'équilibre
thermique.
Fermer le circuit électrique, déclencher le chronomètre. Agiter doucement et relever la température toutes les 30 s.
2. On obtient la courbe de variation de température suivante.
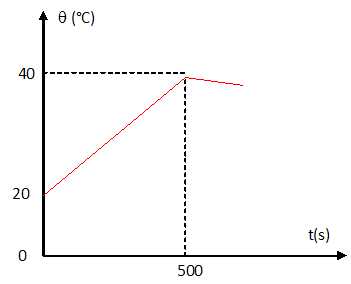
2.1. Comment peut-on expliquer la décroissance de température pout t > 500°C ?
Le vase Dewar n'est pas une enceinte parfaitement adiabatique.
2.2. On note D la durée du chauffage et Dq
l'élévation de la température de la masse m de propylène glycol.
Montrer que la capacité calorifoqie massique du propylène glycol est
:
Cpg = RI2D / mDq - Ccal / m.
Energie fournie par le système de chauffage : Q = RI2D.
Energie gagnée par le propylène glycol : Q1 = m Cpg Dq.
Energie gagnée par le vase Dewar et accessoires : Q2 = CcalDq.
Dans l'hypothèse d'un système adiabatique : Q = Q1+Q2.
RI2D = m Cpg Dq + CcalDq ; Cpg = RI2D / mDq - Ccal / m.
3. On obtient expérimentalement Cpg = 2,49 kJ kg-1 K-1. Le tableau suivant donne Cpg en fonction de la température.
| t °C | 5,85 | 13,85 | 21,85 | 29,85 | 38,85 | | Cpg kJ kg-1 K-1 | 2,396 | 2,442 | 2,489 | 2,536 | 2,589 |
3.1. Le résultat obtenu est-il cohérent avec la valeur théorique ?
Le résultat expérimental est cohérent avec la valeur théorique.
3.2. Critiquer la stratégie expérimentale mise en oeuvre.
Les
différentes mesures, masse, température, intensité, temps sont
entachées d'incertitudes. Il faudrait utiliser un matériel plus
performant que le calorimètre. Il faudrait tenir compte de la
volatilité du propylène glycol.
3.3.
Expliquer comment sont modifiés les transferts thermiques lorsque l'on
ajoute du propylène glycol dans le circuit d'eau. On donne Ceau =4,185 kJ kg-1 K-1.
La
capacité thermique massique du mélange eau propylène glycol sera
inférieure à celle de l'eau. Les transferts thermiques diminuent avec
l'augmentation de la proportion de propylène glycol.
|
|