QCM chimie.
Concours kiné ader.. 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
|
|
|
|
|
|
|
|
|
64. D'après concours manipulateur radio ST Germain 2010.
Dans un ballon, on réalise la réaction entre le carbonate de calcium et l'acide chlorhydrique ( H3O+aq+ Cl-aq ). Le dioxyde de carbone formé est recueilli par déplacement d'eau dans une éprouvette graduée.
Un élève verse dans le ballon un volume VS =100 mL d'acide
chlorhydrique à 0,100 mol/L. A la date t=0, il introduit rapidement
dans le ballon 2,00 g de carbonate de calcium tandis qu'un camarade
déclenche un chronomètre. Les élèves relèvent le volume VCO2
de dioxyde de carbone dégagé en fonction du temps. Puis après avoir
calculé les valeurs de l'avancement, ils ont reportés les résultats sur
le graphe x = f(t). On donne Vm = 24 L/mol.
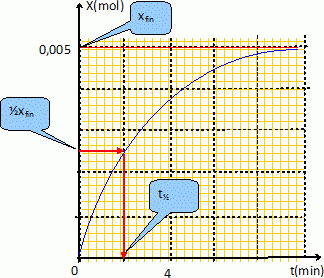
La réaction chimique étudiée peut être modélisée par l'équation :
CaCO3(s) + 2 H3O+aq = Ca2+aq + CO2(g) + 3 H2O(l).
Déterminons les quantités de matière initiales de chacun des réactifs.
n(H3O+aq) = 0,1 VS = 0,1*0,1 = 0,01 mol.
M(CaCO3) = 40 +12+3*16 = 100 g/mol ; n(CaCO3) = m / M = 2,0 / 100 = 0,02 mol.
0,01 mol d'acide réagit avec 0,005 mol de carbonate de calcium. Ce dernier est en excès.
Il se forme 0,005 mol de dioxyde de carbone soit 0,005*24 = 0,12 L.
Les
réponses exactes sont A et B.
65. CaCl2 anhydre.
CaCl2(s) ---> Ca2+ aq +Cl-aq.
Quantité de matière initiale de chlorure de calcium.
M(CaCl2) =40 +2*35,5 = 111 g/mol.
n(CaCl2) = 1,11 103 / 111 = 10,0 mol.
La dissolution du solide étant totale, l'avancement final est égal à 10,0 mol.
Concentration finale des ions calcium : [Ca2+aq] = n(CaCl2) / V = 10,0 / 2,0 = 5,0 mol/L.
La solution est électriquement neutre : [Cl-aq]=2[Ca2+aq] = 10 mol/L
Les
réponses exactes sont A, C et E.
A est vrai si on ne tient pas compte des chiffres significatifs, sinon faux.
|
|
|
|
66. Chaufferette chimique.D'après bac S métropole 09 /2011.
Une chaufferette chimique contient une solution aqueuse S0 d'éthanoate de sodium (CH3COO-aq + Na+aq).
Le volume de la solution est V0 = 100 mL et sa masse est m =130 g.
La solution S0 étant trop concentrée pour être dosée directement, on prépare une solution S1 en diluant 100 fois S0.
Titrage de la solution S1.
On place dans un becher un volume V1 = 25,0 mL de S1.
On réalise un titrage par pHmétrie par une solution d'acide chlorhydrique ( H3O+aq+Cl-aq) de concentration cA = 0,20 mol/L. On note VA le volume de la solution d'acide chlorhydrique versé.
L'équation de la réaction chimique support du dosage s'écrit :
H3O+aq + CH3COO-aq = CH3COOH aq +H2O(l).
A l'équivalence, les
quantités de matière des réactifs mis en présence sont en proportions
stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès,
après l'équivalence, l'autre réactif est en excès.
n(H3O+aq) = CAVA eq ; n(CH3COO-aq) =V1 [CH3COO-aq]1.
CAVA eq = V1 [CH3COO-aq]1 avec VA eq =9,0 mL.
Concentration c1 en ion éthanoate dans la solution S1.
[CH3COO-aq]1 = CAVA eq =/ V1 =0,20*9,0 /25=0,0704 ~0,072 mol/L.
Par suite c0 = 100 c1 = 100 *0,072 = 7,2 mol/L ou 0,72 mol dans 100 mL.
La solubilité de l'éthanoate de sodium étant de 4,5 mol/L à 25°C, la solution est saturée.
M(éthanoate de sodium )~ 100 g/mol.
Masse d'éthanoate de sodium dans la chaufferette : 0,72*100 ~72 g.
Les
réponses exactes sont C et D.
67. RMN.
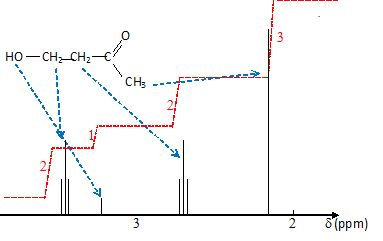
La
réponse exacte est D.
68. Combustion d'un hydrocarbure.
CxHy + (x+0,25y)O2 ---> xCO2 +½yH2O.
M(CxHy) =12 x+y.
Quantité de matière de dioxyde de carbone n (CO2)=4,4 / M(CO2) = 4,4 /44 = 0,10 mol.
Quantité de matière d'eau : n(H2O) = 1,8 /M(eau) = 1,8 / 18 = 0,10 mol.
Par suite x = ½y soit y = 2x. L'hydrocarbure est un alcène de formule brute CxH2x.
Masse de carbone dans l'hydrocarbure : 4,4 /44 *12 =1,2 g.
Masse d'élément hydrogène dans l'hydrocarbure : 1,8 /18*2 = 0,2 g.
masse m d'hydrocarbure : 1,4 g.
Les
réponses exactes sont D et E.
|
69. pH d'une solution.
Quantités
de matière initiales : n( ac. sulfamique) =10 / M(ac. sulfamique)
~ 10 / 100 =0,10 mol dans 500 mL d'eau soit 0,10 *25 / 500 =0,005 mol
dans 25 mL.
n(soude) = cV =0,25 *0,020 = 0,005 mol.
Les quantité de matière des réactifs sont en proportions
stoechiométriques. La soude est une base forte, l'acide sulfamique est
un acide fort.
Le pH du mélange est égal à 7. Réponse C.
70. Rendement d'une synthèse.
2 benzaldéhyde + propanone ---> produit +2H2O.
Quantités de matière initiales : n(benzaldehyde) = 5,3 / 106 = 0,050 mol.
n(propanone) ~ 3,0*0,80 / 60 ~0,04 mol ( en excès ).
0,050 mol de benzaldehyde réagit avec 0,025 mol de propanaone pour donner 0,025 mol de produit.
On peut espérer obtenir au mieux 0,025 M(produit) = 0,025*234 = 5,85 g de produit.
Rendement : masse réelle / masse expérimentale *100 = 4,68 / 5,85 *100 ~80 %. Réponse A. |
|