QCM chimie.
Concours kiné Berck 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
1. Dismutation de l'ion thiosulfate.
Il
se dismute lentement en milieu acide donnant du soufre solide. On
réalise cette réaction dans un bécher, placé sur une feuille de papier
sur laquelle on a tracé une croix noire. On mesure à l'aide d'un
chronomètre la durée de l'opacification de la solution, c'est à dire la
durée au bout de laquelle la croix n'est plus visible par un
observateur placé à la verticale du becher.
Dans le becher, on verse le même volume V1 d'une solution de thiosulfate de sodium de concentration c1 = 0,25 mol/L et un volume V2 d'eau distillée. A l'instant t=0, on verse un volume V3 d'une solution d'acide chlorhydrique de concentration c3 = 1,00 mol/L et on mesure la durée d'opacification du mélange.
Expérience
|
V1(mL)
|
V2(mL)
|
V3(mL)
|
Durée (s)
|
1
|
10
|
34
|
6
|
130
|
2
|
20
|
24
|
6
|
90
|
Couples oxydo-réducteur mis en jeu : S2O32-aq / S(s) ; SO2aq / S2O32-aq.
Combien y a t-il d'affirmations exactes ?
- L'équation de cette réaction s'écrit :
S2O32-aq + 2H3O+aq --> S(s)+SO2 aq + 3H2O(l). Vrai.
- Dans les expériences, le réactif limitant est l'ion thiosulfate.
c1V1 = 0,25*10 = 2,5 mmol ( expérience 1) et 5,0 mmol ( expérience 2) ; c3V3 =6,0 mmol.
Or une mole de thiosulfate réagit avec 2 moles d'ion oxonium. Le
réactif limitant est l'ion thiosulfate uniquement dans l'expérience 1.
- Dans l'expérience 1, la concentration molaire initiale en ion thiosulfate est 50 mmol/L. Vrai.
2,5 / 50 = 0,050 mol/L = 50 mmol/L.
- La durée d'opacification diminue quand la concentration initiale d'ion thiosulfate diminue.
- Dans l'expérience 2, la masse de soufre présent à l'état final est m = 0,19 g.
L'ion oxonium est le réactif limitant : il se forme 3 mmol de soufre soit 3 *32 = 96 mg.
2. suite.
Déterminer
la concentration molaire des ions oxonium ( mmol/L) présents à
l'état final ( expérience 1). 0 ; 10 ; 20 ; 40 ; 50 ; aucune réponse
exacte.
5
mmol d'ion oxonium réagissent avec 2,5 mmol d'ion thiosulfate. Il reste
1 mmol d'ion oxonium dans 50 mL de solution soit 1/50 = 0,020 mol/L ou 20 mmol/L.
3. Titrage de l'acide oxalique.
L'acide oxalique est un solide de formule C2H2O4,2H2O. On dissout m = 4,50 g de solide dans de l'eau distillée pour obtenir 250 mL de solution S1. On prélève V1 = 20,0 mL de S1.
On procède au titrage de l'acide oxalique contenu dans ce becher par
les ions permanganate de concentration c = 100 mmol/L. Il faut verser Véq = 10,2 mL de solution de permanganate de potassium acidifié pour parvenir à l'équivalence. L'équation de la réaction s'écrit :
2MnO4-aq + 5C2H2O4 aq +6H3O+aq --->2Mn2+aq + 10CO2aq + 14H2O(l).
Calculer le pourcentage massique ( en %) d'acide oxalique dans l'échantillon.
42 ; 61 ; 71 ; 82 ; 89 ; aucune réponse exacte.
n(MnO4-aq) =10,2 *0,100 = 1,02 mmol.
n( acide oxalique) = 2,5 n(MnO4-aq) = 2,5 *1,02 =2,55 mmol.
M( C2H2O4,2H2O ) = 126 g/mol.
Masse d'acide oxalique : 126*2,55 = 321 mg = 0,321 g dans 20 mL soit 4,01 g dans 250 mL de S1.
4,01 / 4,50*100 ~89 %.
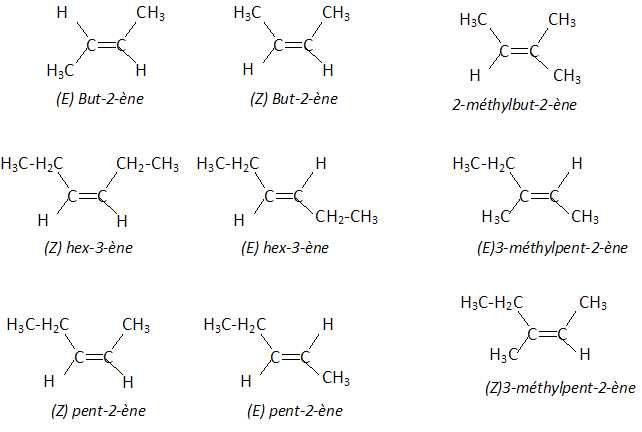
4. Diastéréoisomérie Z E.
Voici 5 molécules : but-2-ène, pent-2-ène, hex-3-ène, 2-méthylbut-2-ène, 3-méthylpent-2-ène.
Indiquer le nombre de molécules qui présentent la diastéréoisomérie Z E.
|
|
|
5.Identifier une molécule organique.
Une molécule organique donne un test positif à la DNPH et un test négatif à la liqueur de Fehling. On donne son spectre RMN.

5,7 ; 15 ; 22 ; 27 ; 32 ; aucune réponse exacte.
Les deux test indiquent la présence d'une cétone.
Le spectre RMN indique la présence d'un méthyl en alpha du groupe
carbonyle ( singulet à 2,2 ppm) ainsi que l'existence du groupe CH2-CH3.
CH3-CH2-CO-CH3 : butanone.
|
|
|
|
Exercice. Hydrolyse du chlorure de tertiobutyle (CH3)3C-Cl.
On le notera sous la forme R-Cl. La réaction d'hydrolyse est modélisée par l'équation :
RCl aq + 2H2O(l) --> R-OH aq +H3O+aq +Cl-aq.
Cette réaction est suffisamment lente pour être suivie par conductimétrie. On supposera cette réaction comme totale.
On
dissout une masse m = 1,00 g de chlorure de tertiobutyle dans de
l'acétone pour obtenir 250,0 mL de solution S. Le chlorure de
tertiobutyle ne réagit pas avec l'acétone qui joue donc uniquement
le rôle de solvant. A t=0, on verse un volume V1 = 80,0 mL d'eau distillée dans un becher et on immerge la sonde du conductimètre dans ce becher. A t =0, on verse un volume V2 = 2,0 mL de la solution S dans ce becher. On relève la conductivité s
du mélange réactionnel en fonction du temps. Cette réaction se déroule
à 25°C. On obtient la courbe ci-dessous. L'eau est en excès dans cette
réaction. L'état final n'est pas atteint à la date t= 100 s.
Conductivité molaire ionique ( mS m2 mol-1) à 25°C : l H3O+ = 35,0 ; lCl- = 7,63.
1. Préciser la catégorie de réaction en chimie organique à laquelle appartient l'hydrolyse du chlorure de tertiobutyle.
Réaction de substitution. Le groupe Cl est remplacé par le groupe OH.
2. Calculer la quantité de matière initiale n0 ( en µmol ) de chlorure de tertiobutyle introduite dans le becher.
M(RCl) = 4*12 +9+35,5 = 92,5 g/mol.
n =m / M(RCl) =1,00 / 92,5 = 0,0108 mol = 10,8 mmol dans 250 mL de S.
n0 = 0,0108 *2 / 250 =8,65 10-5 mol = 86,5 µmol.
3. Calculer la conductivité maximale( en mS m-1) du mélange réactionnel à l'état final.
smax = ( l H3O+ + lCl- ) C avec C = [H3O+]fin=[Cl-]fin =n0 / (V1+V2) = 8,65 10-5 /(82 10-6)= 1,055 mol m-3.
smax =(35,0 +7,63) *1,055 =44,96 ~45,0 mS m-1.
4. En déduire le temps de demi-réaction t½ en seconde.
A t½, la conductivité est égale à la moitié de la conductivité maximale.
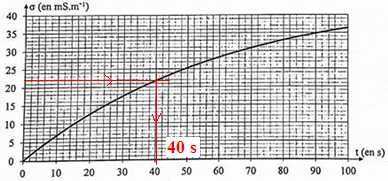
5. Calculer la masse m(ROH) en mg d'alcool à l'instant t½.
n(ROH) = ½n0 = 4,33 10-5 mol ; M(ROH) = 74 g/mol.
m(ROH) = 4,33 10-5 *74 =3,20 10-3 g = 3,20 mg.
On
titre les ions oxonium présents dans le becher à l'état final, par une
solution aqueuse d'hydroxyde de sodium de concentration molaire cb = 5,00 10-3 mol/L.
6. Déterminer le volume Véq ( en mL) de solution aqueuse d'hydroxyde de sodium à l'équivalence.
CbVéq=n0 ; Véq=n0 / Cb =8,65 10-5 / (5,00 10-3)=1,73 10-2 L= 17,3 mL.
|
|