L'acide
glycolique,
bac
S Asie 2017 .
|
|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
L'acide glycolique est le plus petit
des acides α-hydroxylés HOOC- CH 2OH , il sera noté AH.
L'acide glycolique peut être obtenu à partir d'extrait de canne à
sucre, de betterave ou de raisin.
Grâce à son excellente capacité à pénétrer la peau, l'acide glycolique
est très utilisé dans les produits de soins pour la peau, le plus
souvent dans les peelings (technique destinée à régénérer la peau du
visage).
L'acide glycolique permet d'améliorer la texture et l'apparence de la
peau. Il peut réduire les rides, l'acné ou l'hyperpigmentation.
D’après https://fr.wikipedia.org/wiki/Acide_glycolique.
Partie A : étude de l’acide glycolique.
1. En nomenclature
officielle, l’acide glycolique s’appelle l’acide hydroxyéthanoïque.
Justifier le nom officiel de cet acide.
La chaine carbonée compte deus atomes de carbone
L'un porte le groupe carboxyle COOH, l'autre le groupe hydroyle OH.
2. L’acide
glycolique possède-t-il des stéréoisomères de configuration ? Justifier.
Non, il n'y a ni carbone asymétrique, ni double liaison C=C.
La canne à sucre subit deux broyages donnant un liquide sucré appelé le
« vesou ». Celui-ci contient des acides organiques dont l’acide
glycolique.
3. Une
chromatographie révélée par le bleu de bromophénol permet de vérifier
que le « vesou » contient bien de l’acide glycolique.
Bleu de bromophénol : forme acide, jaune ; forme basique, bleu ; zone
de virage 3,0 - 4,6.
L’éluant, de pH = 2, est un
mélange de :
- 70% de butan-1-ol ;
- 30% de solution concentrée d’acide éthanoïque ;
- Quelques gouttes de solution à 1 g.L-1 de bleu de
bromophénol.
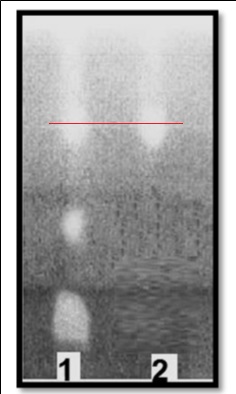
Nature des dépôts : - dépôt 1 : vesou ;
- dépôt 2 : acide glycolique pur.
Lors du séchage de la plaque de chromatographie, l’acide éthanoïque
s’évapore.
Après séchage, le chromatogramme, reproduit ici en noir et blanc,
présente en réalité des taches jaunes sur fond bleu. |
|
3.1. Quelle est la
couleur de l’éluant ?
A pH=2, le bleu de bromophénol est
jaune.
3.2. Proposer une
explication des couleurs des taches observées sur le chromatogramme
après séchage et interpréter le chromatogramme.
Après séchage, l'acide éthanoïque s'est évaporé ; le pH du support est
supérieur à 4,6. La forme basique du bleu de bromophénol est bleue. Par
contre les taches contenant de l'acide glycolique ont un pH inférieur à
2, l'indicateur coloré est jaune.
4. En supposant que
la teneur en masse d’acide glycolique dans la matière organique
extraite du « vesou » est de 0,1%, quelle masse de « vesou » serait
nécessaire pour obtenir 100 mL d’acide glycolique pur ?
Masse volumique de l'acide glycolique : 1,49 g / mL.
Masse d'acide glycolique contenu dans 100 mL : 100 x 1,49 = 149 g.
Masse de "vesou" : 149 / 0,001=149 000 g ou 149 kg ~1,5 102 kg.
5. Dans
l'industrie, l'acide glycolique n'est pas extrait de la canne à sucre
mais synthétisé à partir du glyoxal, selon une réaction de Cannizzaro
d’équation suivante :
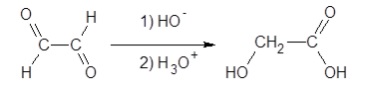
Un spectre infrarouge du produit finalement obtenu est donné ci-après.
Avancer deux arguments pour justifier qu’il peut correspondre à l’acide
glycolique.
|
....
.....
|

Partie B : étude d’une
solution dermatologique d’acide glycolique.
En dermatologie, il existe plusieurs solutions aqueuses, de
concentrations différentes en
acide glycolique, utilisées dans le traitement de l’acné : 20% ; 35% ;
50% ou 70% en masse
d’acide glycolique.
Pour rédiger l’étiquette d’une solution d’acide glycolique en
dermatologie, on se propose
d’en déterminer les caractéristiques : masse volumique et pourcentage
massique d’acide glycolique.
1. Proposer une
méthode pour déterminer expérimentalement la masse volumique de la
solution d’acide glycolique. Sachant que la solution a une masse
volumique ρ = 1,26 g.cm-3, indiquer le matériel utilisé, les
valeurs des prélèvements et les mesures correspondant à la méthode
choisie.
Placer un becher de 50 mL sur le plateau d'une balance de précision (
0,01 g) et faire le zéro ( tarer la balance).
Prélever 10,0 mL de la solution d'acide glycolique à l'aide d'une
pipette jaugée de 10,0 mL..
Verser le prélevement dans le becher et noter l'indication de la
balance.
Diviser cette lecture par 10.
Ou bien placer une fiole jaugée sèche des100,0 mL sur une balance et
noter sa masse.
Placer le liquide dans un becher propre et sec ; verser le liquide
lentement jusqu'à ce que le bas du ménisque soit sur le trait de
jauge. Terminer à l'aide d'une pipette simple.
Placer la fiole pleine sur la balance et noter sa masse.
Faire la différence des masses et diviser par le volume de la fiole
jaugée.
2. Pour déterminer
le pourcentage massique d’acide glycolique, on réalise le titrage
décrit ci-dessous dans ses grandes lignes.
On dispose de 50 mL d’une solution d’acide glycolique que l’on dilue
vingt fois. On réalise le titrage suivi par pH-métrie d’une prise
d’essai de 10,0 mL de la solution diluée par une solution aqueuse
d’hydroxyde de sodium, (Na+(aq) + HO -(aq)), de
concentration molaire égale à 0,50 mol.L-1. On obtient les
résultats expérimentaux suivants.
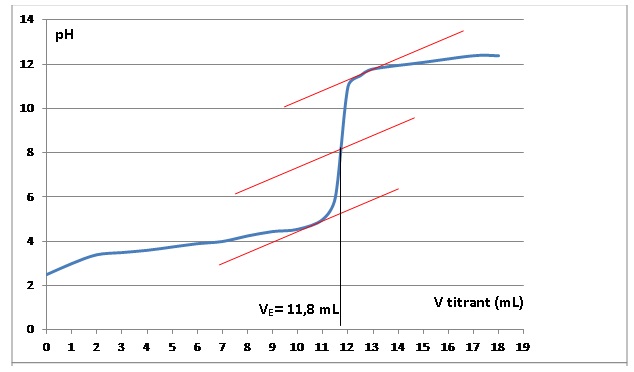
|
|
|
2.1
Décrire la préparation de 100,0 mL de solution dermatologique diluée 20
fois.
Prélever 5,00 mL de la solution mère à l'aide d'une pipette jaugée de
5,00 mL.
Verser dans une fiole jaugée de 100,0 mL contenant un tires d'eau
distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge.
Boucher et agiter ppour rendre homogène.
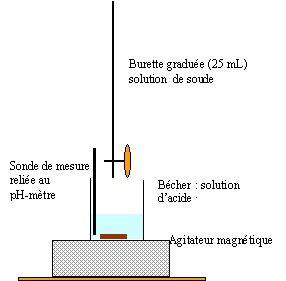
2.2 Réaliser un
schéma annoté du montage permettant d’effectuer le titrage.
Le diagramme de distribution des espèces du couple acide glycolique /
ion glycolate
représenté ci-dessous donne le pourcentage de chaque forme en fonction
du pH.
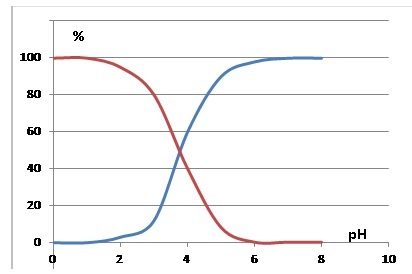
2.3. Identifier,
sur le diagramme de distribution, la courbe correspondant à l’acide
glycolique (AH) et celle correspondant à l’ion glycolate A-.
Justifier.
pKa (AH / A-) = 3,83.
A pH inférieur à 3,83, la forme AH prédomine ( courbe rouge ).
A
pH supérieur à 3,83, la forme A- prédomine ( courbe bleue ).
2.4 Quelle est la
forme prédominante du couple acide glycolique / ion glycolate (AH / A-)
au début du titrage ? Puis à la fin du titrage ? Justifier.
Au début du titrage, le pH est inférieur à 3,83, la forme AH prédomine.
A la fin du titrage, le pH est supérieur à
3,83, la forme A- prédomine.
2.5 En déduire l’équation chimique
de la réaction support du titrage.
AHaq +HO-aq ---> A-aq +H2O(l).
2.6 Quel
pourcentage massique d’acide glycolique doit être indiqué sur
l’étiquette ?
A l'équivalence : [AH] =VE Cb / Vprise
= 11,8 x 0,50 / 10,0 =0,59 mol/L
Tenir compte de la dilution : 20 x0,59 = 11,8 ~12 mol / L.
M(AH) = 76 g/mol.
Masse d'acide glucolique dans 1 L : 11,8 x76 =896,8 g.
Masse volumique de la solution d'acide glucolique : 1,26 kg / L.
Masse de 1 L : 1,26 kg.
Pourcentage massique d'acide glucolique : 896,8 / 1260 x100 =71,17 ~72 %.
|
|