L'acide
lévulinique, une molécule qui a de l'avenir.
Bac S Liban 2017 .
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
L'acide
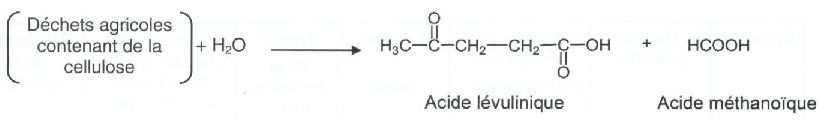
lévulinique est synthétisé à partir de la cellulose ( (C 6H 10O 5)n
) présente dans les déchets agricoles.
 1 :Optimisation du protocole de synthèse
de l'acide lévulinique
1 :Optimisation du protocole de synthèse
de l'acide lévulinique.
Les chercheurs ont réalisé six synthèse en faisant varier différents
paramètres.
Chaque synthèse est réalisée sous agitation à 200°C. Un volume d'eau V
= 24 mL contenant le catalyseur en quantité désirée a été mélangé à une
masse m = 1,75 g de matière première ( déchets agricoles) réduite en
poudre sous atmosphère inerte en diazote.
Synthèse
|
Matière
première
|
Teneur
en
cellulose ( % massique)
|
Irradiation
micro-ondes
|
Durée
de la
synthèse (min)
|
Catalyseur
(quantité en mol pour
une mole de cellulose)
|
Rendement
(%)
|
1
|
Branches
olivier
non productives
d'olives
|
39,4
|
oui
|
15
|
0,0115
acide chlorhydrique
|
51
|
2
|
Sciure
de peuplier
|
57,6
|
non
|
60
|
0,0115
acide chlorhydrique
|
37
|
3
|
Sciure
de peuplier |
57,1
|
oui
|
15
|
0,0115
acide chlorhydrique
|
45,8
|
4
|
Boues
de papier
|
57,1
|
non
|
60
|
0,0115
acide chlorhydrique
|
55,1
|
5
|
Boues
de papier
|
57,1
|
oui
|
15
|
0,0115
acide chlorhydrique |
55,5
|
6
|
Boues
de papier
|
57,1
|
non
|
60
|
0,0115
acide sulfurique
|
26,5
|
d'après Galetti et.al (2012) Levulinic Acid from waste, BioResources.
1.1. Citer les
paramètres que les chercheurs ont fait varier.
Nature de la matière première et sa teneur en cellulose, exposition aux
micro-ondes, durée de la synthèse.
1.2.
Identifier le paramètre ayant une influence sur le rendement qui est
mis en évidence par les synthèses 2 et 4. Préciser son influence.
L'irradiation aux micro-ondes augmente le rendement de la synthèse (
tous les autres paramètres étant inchangés)..
1.3.
Identifier le paramètre ayant une influence sur le rendement qui est
mis en évidence par les synthèses 2 et 4. Préciser son influence.
La nature de la matière première contenant le même pourcentage de
cellulose.
Les boues de papier conduisent à un meilleur rendement.
1.4. Quel catalyseur est-il
préférable d'utiliser ? Justifier.
Synthèses 4 et 6 : l'acide chlorhydrique conduit à un meilleur
rendement que l'acide sulfurique.
1.5. Quelle
expérience, parmi celles proposées, correspond à la synthèse de l'acide
lévulinique la plus "verte" possible ? Justifier.
Pour un rendement comparable ( environ 50 %), la synthèse à partir des
branches d'olivier irradiées ( teneur en cellulose 39 % (
économie d'atomes et faible consommation d'énergie due à la durée de
l'expérience ) correspond le plus à la chimie verte.
1.6.
Si le rendement était de 100 %, on obtiendrait une mole d'acide
lévulinique pour une mole d'un motif de cellulose transformé.
Déterminer la masse expérimentale mexp réellement obtenue en
acide lévulinique dans l'expérience 5.
M(motif cellulose)= 162,1 g/mol ; M(acide lévulinique) = 116,1 g/mol.
Rendement 55,5 %.
1 kg de boues de papier contient 571 g de cellulose soit 571
/162,1=3,52 mol de motif élémentaire de cellulose.
On obtient 3,52 x0,555 = 1,955 mol d'acide lévulinique soit mexp=1,955
x116,1 ~227 g par kg de boues.
soit 227 x1,75 / 1000 = 0,397
g dans 1,75 g de boue.
|
....
.....
|
2.Transformation de l'acide lévulinique en
valérolactone.
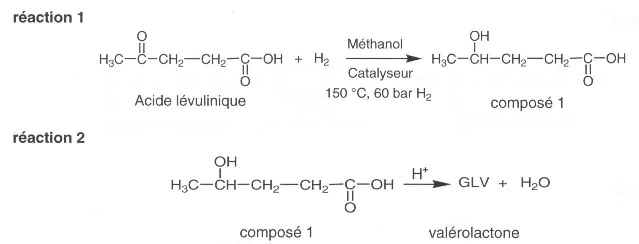
2.1. La
valérolactone peut être synthétisée directement à partir de l'acide
lévulinique.
2.1.1.
Recopier l'équation 1 en utilisant les formules topologiques. Entourer
les groupes caractéristiques et nommer les fonctions correspondantes.
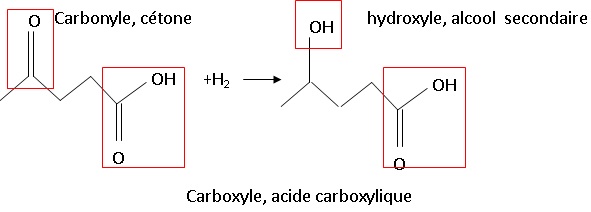
2.1.2. A quelle
catégorie de réaction correspond-elle ?
Addition de H2 sur une double liaison C=O : à partir de deux
réactifs on obtient un seul produit. Une liaison double est rompue, une
liaison siple est crée.
2.1.3 recopier la
formule semi-développée de l'acide lévulinique, entourer les groupes de
protons équivalents et prédire la multiplicité du signal RMN du proton
pour chaque groupe.
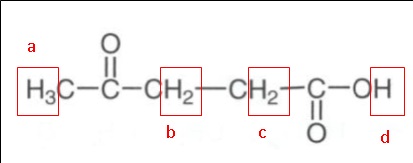
a : singulet, l'atome de carbone voisin ne porte
pas de proton.
b et c : triplet, l'atome de carbone voisin porte deux
protons.
d : singulet, l'atome de carbone voisin ne porte
pas de proton.
2.1.4 Expliquer
comment les chercheurs peuvent s'assurer de l'existence du composé 1, à
la fin de la réaction 1, par spectroscopie IR et par résonance
magnétique nucléaire.
IR : disparition de la bande du
carbonyle ( cétone ) vers 1700 cm-1 et apparition d'une
bande large 3200 à 3400 cm-1 ( OHlié alcool).
RMN du proton : disparition du singulet du groupe CH3
, remplacé par un doublet.
Le signal des protons b devient un quadruplet ; apparition d'un
multiplet correspondant à CH
(OH)
|
|
|
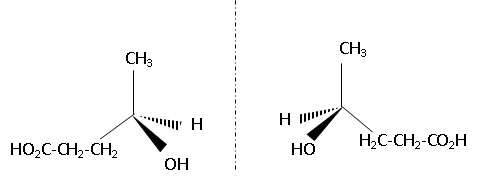
2.1.5.Au
cours de la réaction 1, deux stéréoisomères du composé 1 sont obtenus.
En donner les représentations de Cram. Par quelle relation de
stéréoisomérie sont-ils liés ? Justifier.
L'existence d'un atome de carbone asymétrique conduit à l'existence de
2 énantiomères.
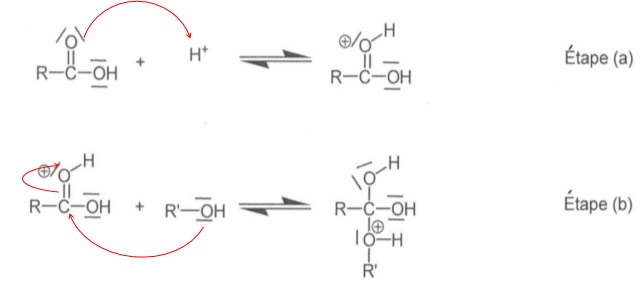
2.1.6.La
réaction 2 est une estérification particulière : la molécule du composé
1 possède deux fonctions qui peuvent réagir entre elles pour donner un
ester cyclique, la valérolactone. Compléter les étapes a et b du
mécanisme simplifié à l'aide du formalisme des flèches courbes.
|
|
|
|
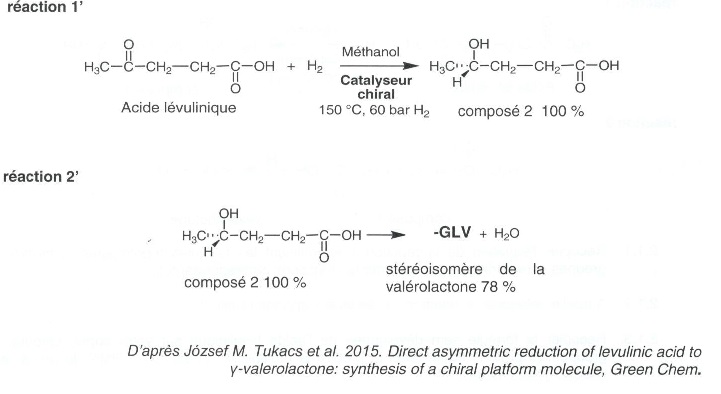
2.
.2 Etude d'une seconde voie sélective.
Un volume V = 0,75 mL d'une solution méthanoïque d'acide lévulinique à
la concentration massique cm
=785 g/L est placé dans une atmosphère chargée en dihydrogène à la
pression de 60 bar et chauffé à 150°C en présence de 0,009 mmol du
catalyseur chiral sous agitation pendant 20 heures. Après traitement et
purification, un volume V' =0,38 mL du stéréoisomère A de la
valérolactone est obtenu sous forme d'un liquide incolore.
2.2.1.
Justifier la nécessité de trouver des synthèses ne menant qu'à un seul
stéréoisomère dans l'industrie pharmaceutique.
Bien souvent un seul des deux stéréoisomères possède des propriétés
pharmaceutiques. Il faut donc les séparer, ce qui nécessite des
procédés de synthèse longs et couteux. Il faut donc privilégier des
synthèses conduisant à un seul stéréoisomère.
2.2.2.
Quelle est la quantité de matière initiale d'acide lévulinique
transformé dans cette synthèse ?
M(acide
lévulinique) = 116,1 g/mol.
n =V Cm / M(acide lévulinique)
=0,75 10-3 x785 / 116,1=5,07 10-3 mol~5,1 mmol.
2.2.3.
Calculer le volume maximal théorique Vmax
de valérolactone susceptible d'être obtenu lors de cette synthèse si le
rendement des deux réactions était de 100 % et le dihydrogène introduit
en excès. Le volume V' réellement obtenu du stéréoisomère de la
valérolactone est-il compatible avec le rendement de 78 % de la
réaction 2' indiqué dans la publication ?
On
peut obtenir au mieux 5,07 mmol de valérolactone soit m= 5,07 x
M(valérolactone) =5,07 x100,1 = 0,5076 g.
Vmax
=m /masse volumique de la valérolactone = 0,5076 /1,05 =0,483 ~0,48 mL.
V' = 0,483 x 0,78~0,38 mL.
V' est compatible avec le rendement indiqué.
|
|