Le développement spectaculaire des
transports permet à des millions de personnes de voyager partout dans
le monde.
Ces déplacements induisent parfois des risques, en particulier la
propagation de maladies transmises par les moustiques.
Une des solutions pour éviter les piqûres est de repousser les
moustiques en utilisant des produits répulsifs cutanés.
L'EHD ou 2-éthylhexan-1,3-diol est un composé organique de synthèse
découvert en 1935 et présentant une activité répulsive vis-à-vis des
moustiques. L'objectif de cet
exercice est d'étudier une voie de synthèse en trois étapes de l'EHD.
Cette première étape est l'oxydation du butan-1-ol par le permanganate
de potassium pour obtenir le butanal
selon la réaction d'équation :
5 C
4H
10O(l) + 2MnO
4-aq +6H
+aq
---> 5 C
4H
8O(l) +2Mn
2+aq + 8 H
2O(l).
Pour produire le butanal, on utilise le montage ci-dessous.
Initialement, le ballon contient 2,0 ml de butan-1-ol. l'ampoule de
coulée permet d'introduire dans le ballon une solution oxydante de
permanganate de potassium (K
+(aq) + Mn0
4-(aq)),
de concentration molaire C = 4,5 X 10
-1 mol.L
-1.
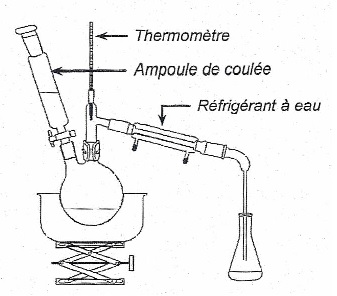
Ce montage permet à la fois de synthétiser le butanal et de l'extraire
du milieu réactionnel par distillation simple.
Si la solution de permanganate de potassium est introduite trop
rapidement, le butanal formé peut être oxydé en acide butanoïque. On
l'introduit donc goutte à goutte dans le milieu réactionnel.
La synthèse est réalisée en présence d'une solution aqueuse d'acide
sulfurique (2H
+(aq) + SO
42-(aq)) et à
une température de 75°C.
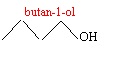
1.1. Donner la
formule topologique du butan-1-ol.
 1.2.
1.2. Indiquer
pourquoi l'utilisation du montage de distillation simple permet
d'extraire le butanal du milieu réaction nel.
Le butanal est l'espèce la plus volatil. Sa température d'ébullition
est égale à 75°C, température maintenue dans le milieu réactionnel.
1.3. Dans
l'hypothèse d'une oxydation dela totalité du butan-1-ol, vérifier que
la masse maximale de butanal est égale à 1,6 g.
Quantité de matière de butan-1-ol, réactif limitant :
volume (mL) x masse volumique ( g/mL) / masse molaire ( g/mol).
2,0 x0,81 / 74 =0,0219 mol
Quantité de matière de butanal : 0,0219 mol.
Masse de butanal : 0,0219 M(butanal) = 0,0219 x72 ~1,6 g.
1.4. Déterminer le
volume de solution de permanganate de potassium nécessaire à introduire
dans l'ampoule de coulée pour oxyder tout le butan-1-ol initialement
présent.
Quantité de matière de permanganate de potassium : 0,0219 /5 x2 =
0,00876 mol.
Volume (L) = quantité de matière (mol) / concentration (mol/L).
0,00876 / 0,45 ~0,019 L (
19 mL).