Le grand four
solaire d'Odeillo
bac
S Amérique du Sud 2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
Perché
à 1535 m d’altitude, le "Grand Four Solaire" d'Odeillo est un
laboratoire de recherche du CNRS (centre national de la recherche
scientifique). D’une puissance de 1000 kW au foyer, il est à ce jour le
four solaire le plus puissant au monde.
Située dans le sud de la France, à 74 km de Perpignan, la commune de
Font-Romeu-Odeillo-Via bénéficie d’un ensoleillement exceptionnel. Elle
est également célèbre pour la pureté de son air.
Partie 1 : fonctionnement du four solaire
La lumière du Soleil est captée par 63 héliostats. De 45 m2
chacun, ils sont mobiles suivant deux axes pour suivre le mouvement
apparent du Soleil tout en réfléchissant les rayons vers un grand
miroir parabolique fixe, aussi appelé concentrateur. Les rayons
réfléchis par les héliostats, parallèles à un axe Nord-Sud, éclairent
toujours la même surface du concentrateur. Réfléchis une deuxième fois
par la parabole du concentrateur, ils viennent enfin se concentrer dans
un foyer situé 18 m en avant. La tache lumineuse fait seulement 40 cm
de diamètre.
Au niveau du foyer, la température peut atteindre 3400 °C.
D’après la vidéo : Odeillo, le Soleil apprivoisé réalisée par le CNRS.
Données
concernant le "Grand Four Solaire"
Le concentrateur (ou parabole) constitué de plusieurs miroirs. Superficie totale de la parabole
: 1830 m2.
Nombre total
de miroirs : 9130
Les héliostats (chaque héliostat est constitué de plusieurs miroirs
plans). Superficie totale : 2835 m2
Nombre total de miroirs : 11340
Données générales
- La réflectivité moyenne des miroirs des héliostats, ainsi que celle
du concentrateur, est estimée à 70%.
La réflectivité correspond au pourcentage de rayonnement incident qui
est réfléchi par la surface d’un matériau.
- On supposera que la puissance reçue par unité de surface de miroir
pendant l’utilisation du "Grand Four Solaire" d’Odeillo est de 720 W/m2.
Compréhension
générale du principe de fonctionnement.
L’objectif est de retrouver, par calcul, la valeur de la puissance
disponible au foyer du "Grand Four Solaire" d’Odeillo.
1.1. Exprimer, puis
calculer, la puissance réfléchie par l’ensemble des héliostats.
Après une première réflexion : 720 x2835 x0,70 ~1,4 106 W.
1.2. Montrer que la
valeur de la puissance au foyer du four d’Odeillo vaut 1,00.106
W.
Après une seconde réflexion : 0,70 x 1,4 106 ~1,0 106
W = 1,0 103 kW.
Une expérience étonnante.
Pendant la phase de mise au point du "Grand Four Solaire", des
expériences ont été réalisées pour tester ses performances.
Une plaque en acier de 10 mm d’épaisseur, positionnée au foyer et
soumise au rayonnement solaire concentré, a ainsi été percée d’un trou
de diamètre 40 cm égal à celui de la tache lumineuse en seulement 1
minute et 27 secondes.
Données.
- L’acier est un mélange principalement composé de fer et de carbone.
Ses caractéristiques varient donc en fonction de sa composition. Pour
celui utilisé, on utilisera les valeurs moyennes suivantes :
température de fusion : 1500°C ;
température d’ébullition : 2800°C ;
masse volumique à l'état solide : 7200 kg.m-3 ;
capacité thermique massique à l'état solide : 460 J.kg-1.°C-1
;
énergie nécessaire à la fusion de 1 kg de cet acier : Lf =
2,50.105 J.kg-1.
- L’énergie E transmise lors de la fusion d’un échantillon de masse m à
température constante est donnée par la relation : E = m.Lf
- Le volume d’un cylindre de longueur e et de rayon R est : V = π. R2.e
|
|
|
|
1.3.
Indiquer, parmi les relations ci-dessous, celle liant la puissance et
l’énergie.
P = E.Δt ; P = E / Δt ( exact)
; P = Δt / E.
1.4. Quelle
conversion d’énergie est réalisée au foyer du concentrateur afin que le
rayonnement solaire concentré puisse percer une plaque en acier ?
L'énergie solaire reçue est convertie en
énergie thermique.
1.5. En déduire la
température minimale atteinte au foyer pendant cette expérience.
L'acier a fondu. La température minimale atteinte est la température de
fusion de l'acier soit 1500°C.
1.6. À l’aide du
texte de fonctionnement du Grand Four Solaire et de la description de
la plaque, montrer que la masse d’acier fondu est de l’ordre de 9 kg.
Volume d'acier fondu : 3,14 x0,22 x0,01 = 0,001256 m3.
Masse d'acier : 0,0012560 x7200 =9,0 kg.
1.7. L’objectif est
de retrouver, par calcul, la durée nécessaire au perçage de la plaque
d’acier et de critiquer le modèle utilisé.
1.7.1. Estimer
l’énergie nécessaire pour élever la température de l’acier jusqu’à sa
température de fusion. On supposera que la température initiale de
l’acier était celle de l’air ambiant, à savoir 20°C.
Energie nécessaire pour chauffer 9,0 kg d'acier de 20°C à 1500°C
: 460 x 9,0 (1500-20) ~6,1 106
joules.
1.7.2. Estimer l’énergie nécessaire
à la fusion de l’acier.
Energie nécessaire pour fondre
9,0 kg d'acier à 1500°C : m Lf = 9,0 x2,5 105
=2,25 106 ~2,3 106
joules.
1.7.3. En déduire la durée
nécessaire théorique pour réaliser cette expérience.
Etotale =(6,1 +2,25) 106 ~8,35 106.
Puissance du four P = 1,0 106 W.
Durée : 8,35 106 / (1,0 106)
~8 s.
1.7.4. Comparer le résultat obtenu
par calcul au résultat expérimental.
1 min 27 s = 87 s ; la valeur trouvée par calcul est environ dix fois
plus petite.
1.7.5. Expliquer la
différence entre ces deux résultats en identifiant des transferts
thermiques qui n’ont pas été pris en compte dans le modèle.
Une
partie de l'énergie fournie par le four sert à chauffer l'ensemble de
la plaque d'acier ainsi que l'air et les matériau se trouvant à
proximité. Une partie de l'acier a pu passer à l'état gazeux.
Partie 2 : la
synthèse du dihydrogène par voie solaire
Le four solaire d'Odeillo permet d'envisager différents modes de
synthèse du dihydrogène. L'objectif de cette partie est d'en étudier
deux et de les comparer à la synthèse par vaporeformage du méthane.
Dans cette première partie,
l’étude est centrée sur le vaporeformage du méthane.
Données :
Masses molaires atomiques (en g.mol-1) : MH = 1,0
MC = 12,0 MO = 16,0
Ce procédé de vaporeformage se déroule en 3 étapes.
La synthèse
industrielle du dihydrogène par vaporeformage du méthane.
Plus de 95 % de la production de dihydrogène se fait à partir de
combustibles fossiles. Parmi les différents procédés, le vaporeformage
est de loin le plus employé.
1ère étape : la désulfuration
L’objectif de cette étape est d’extraire le sulfure d’hydrogène présent
dans le gaz naturel. Cette extraction utilise de la
méthyldiéthanolamine (MDEA) dont la formule topologique est donnée
ci-dessous.
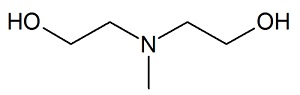
La MDEA et le sulfure d’hydrogène sont dissous en solution aqueuse et
réagissent entre eux. L’équation de la réaction correspondante est la
suivante :
H2S(aq) + MDEA(aq) --> HS−(aq) + MDEAH+(aq)
2.1. Donner la
formule brute de la MDEA.
C5H13NO2.
2.2. Justifier que
cette réaction est une réaction acide-base et donner les couples mis en
jeu.
H2S(aq) / HS−(aq) et MDEAH+(aq) / MDEA(aq).
Echange d'un proton entre H2S(aq) et MDEA(aq).
2.3. Le pH
d’une solution aqueuse de MDEA de concentration molaire 0,10 mol.L-1
est égal à 10,7. Déterminer si la MDEA est un acide fort, une base
forte, un acide faible ou une base faible.
Un pH supérieur à 7 indique la présence d'une base.
Une base forte de concentration 0,1 mol/L a un pH égal à 13. Une base faible de concentration égale
à 0,1 mol/L a un pH inférieur à 13, tout en restant qsupérieur à 7.
|
|
|
|
2ème étape
Lors de cette deuxième étape réalisée à haute température (entre 850 et
900°C) et sous pression (20 à 30 bars), le méthane présent dans le gaz
naturel désulfuré réagit avec l'eau en présence d’un catalyseur à base
de nickel pour former du dihydrogène et du monoxyde de carbone.
2.4. Écrire
l’équation de cette réaction.
CH4 + H2O -->3 H2 + CO.
3ème étape
Lors de cette dernière étape, on fait réagir le monoxyde de carbone
obtenu précédemment avec de l’eau : CO + H2O → CO2
+ H2.
2.5. Quel est
l’intérêt de cette dernière étape ?
Conversion du monoxyde de carbone en présence d'eau en dihydrogène. On
augmente la production de dihydrogène.
Le dihydrogène obtenu est ensuite séparé du dioxyde de carbone et
purifié.
Ce procédé présente un rendement élevé (de l’ordre de 80%). Il a un
coût de production attractif (environ 2 euros le kg de dihydrogène)
mais libère du dioxyde de carbone.
2.6. La synthèse du
dihydrogène par vaporeformage peut être modélisée par une réaction qui
correspond au bilan des réactions des deuxième et troisième étapes.
Montrer que l’équation de cette réaction s’écrit :
CH4 + 2H2O → CO2 + 4H2.
Secone étape : CH4 + H2O -->3 H2
+ CO.
Etape 3 : CO + H2O → CO2 + H2.
Ajouter : CH4 + 2H2O → CO2 + 4H2.
En déduire la masse de dioxyde de carbone formé pour 1,0 kg de
dihydrogène produit.
n(CO2 )= 0,25 n(H2) = 0,25 x1000 / M(H2)
= 250 / 2 = 125 mol.
m(CO2 )= 125 M(CO2) = 125 x44 = 5500 g =5,5 kg.
La synthèse du dihydrogène
par voie solaire
Un des objectifs du four solaire d’Odeillo est de réussir à produire du
dihydrogène sans émettre de gaz à effet de serre tel que le dioxyde de
carbone. Il existe deux procédés de synthèse par voie solaire.
Procédé 1
: la décomposition directe du gaz naturel (CH4) à 3000°C
dans un réacteur solaire.
Il faut ensuite séparer le dihydrogène des particules de carbone.
Procédé 2
: la décomposition de l’eau par cycles
Les chercheurs ont mis au point plusieurs cycles de réactions chimiques
dont le bilan global permet la production de dihydrogène à partir
d’eau. Deux cycles sont étudiés dans cette question.
Cycle 1(mettant
en oeuvre du zinc)
- Étape 1 réalisée dans le réacteur solaire à 1700 °C : ZnO --> Zn +
½ O2
- Étape 2 réalisée dans le réacteur classique à environ 800 °C : Zn + H2O
--> ZnO + H2.
Cycle 2
(mettant en oeuvre du fer)
- Étape 1 réalisée dans le réacteur solaire à 1600 °C : Fe2O3
--> 2 FeO + ½ O2
- Étape 2 réalisée dans le réacteur classique à environ 600 °C :
2 FeO + H2O --> Fe2O3 + H2.
2.7. Écrire
l’équation de la réaction qui correspond au bilan de la transformation
mise en oeuvre dans le cycle 1.
H2O --> H2. + ½ O2
2.8. Quels sont les
deux intérêts du procédé de décomposition par cycles de l’eau par
rapport au procédé de la décomposition directe du gaz naturel ?
Pas de production de dioxyde de carbone, gaz à effet de serre.
L'énergie consommée est moindre ( la température est au maximum
de 1700°C dans le procédé 2, alors qu'elle atteint 3000 °C dans le
procédé 1).
Comparaison des
deux voies de synthèse
2.9. Dans le cadre
de la chimie verte, trouver deux intérêts en faveur de la synthèse du
dihydrogène par voie solaire par rapport à la synthèse industrielle du
dihydrogène.
Utilisation de ressouces renouvelables à la place des produits fossiles.
Limitation des dépenses énergétiques ( utilisation de l'énergie
solaire).
Pas de production de dioxyde de carbone.
|
|
|