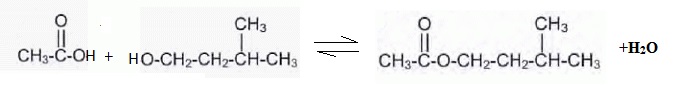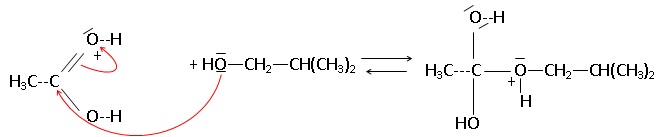L'acétate
d'isoamyle.
bac S Amérique du Nord 2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
Les
esters sont des composés organiques volatils souvent utilisés pour
produire des arômes et des fragrances synthétiques. L’ester étudié dans
cet exercice est l’acétate d’isoamyle, un ester dont la saveur et
l’odeur sont ceux de la banane.
L’équation de la réaction de la synthèse, en présence d’acide
sulfurique, s’écrit :
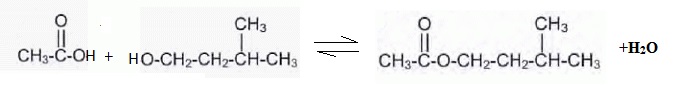
L’objectif de cet exercice est de comparer plusieurs protocoles de
synthèse de l’acétate d’isoamyle
1. Réaction de
synthèse de l’acétate d’isoamyle et mécanisme réactionnel
1.1. Quels sont les
noms, en nomenclature officielle, de l’acide acétique et de l'alcool
isoamylique ?
Acide éthanoïque et 3-méthylbutan-1-ol.
1.2. Compléter le mécanisme
réactionnel de l’étape 2 à l’aide de flèches courbes, puis indiquer la
catégorie de réaction de l’étape.
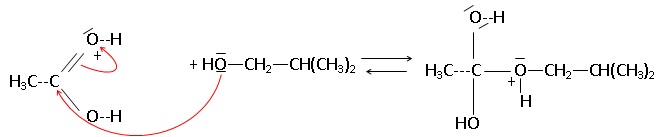
Réaction d'addition sur le carbonyle protoné : à partir de deux
réactifs, on obtient un seul produit. Une liaison double est rompue,
une liaison simple est créée.
1.3. Les ions H+,
provenant de l’acide sulfurique, jouent le rôle de catalyseurs de la
réaction. Que
peut-on attendre lors d’une autre étape du mécanisme réactionnel de
cette réaction de synthèse ?
Dans une autre étape du mécanisme, les ions H+ catalyseur
sont régénérés.
2. Synthèse de
l’acétate d’isoamyle par chauffage à reflux
On réalise cette synthèse au laboratoire en mettant en oeuvre le
protocole expérimental suivant :
- introduire 20 mL d’alcool isoamylique, 15 mL d’acide acétique,
quelques grains de pierre ponce et1 mL d’acide sulfurique concentré
dans le ballon ;
- chauffer à reflux en maintenant une ébullition douce pendant 30 min ;
- laisser refroidir, puis transférer le contenu du ballon dans une
ampoule à décanter. Éliminer la
phase aqueuse ;
- sécher la phase organique ;
- purifier l’ester par chromatographie sur colonne.
Cette synthèse permet d’obtenir un volume d’ester égal à 20,4 mL.
2.1. Compléter le
montage utilisé lors de la mise en oeuvre de la synthèse en indiquant
le nom du matériel et les espèces chimiques présentes. Identifier et
justifier les éléments de sécurité présents dans ce montage et ceux que
doit utiliser le technicien de laboratoire.
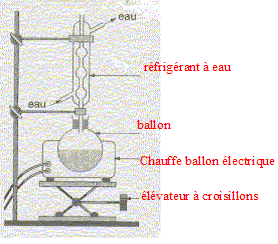
Le ballon contient les
réactifs : 20 mL d’alcool isoamylique, 15 mL d’acide
acétique, quelques grains de pierre ponce et1 mL d’acide sulfurique
concentré.
La potence évite la chute du réfrigérant ; l'élévateur à croisillons
permet d'éloigner rapidement le chauffe ballon.
Le technicien doit porter une blouse , des gants et des lunettes.
|
|
|
2.2. Montrer que l’acide acétique
est introduit en excès.
Quantité de matière d'acide acétique : volume x masse volumique /
masse molaire
15 x1,05 /60,1 =0,26 mol.
Quantité
de matière d'alcool : volume x masse volumique / masse molaire
20 x0,81 /88,1 =0,1826 ~0,18 mol.
0,18 mol d'alcool réagit avec 018 mol d'acide acétique. Il reste un
excès d'acide égal à 0,26-0,18 = 0,08 mol.
2.3. Déterminer la valeur du volume
d’ester attendu lors de cette synthèse si la transformation était
totale.
On peut obtenir 0,1826 mol d'ester soit un volume égal à : quantité de
matière x masse molaire de l'ester / masse volumique de l'ester
=0,1826 x 130,2 / 0,87 =27,3 ~27 mL.
2.4. Si on
réalisait cette synthèse avec un mélange équimolaire des réactifs, son
rendement serait
égal à 65 %. Le choix d’introduire un réactif en excès par rapport à un
mélange équimolaire des
deux réactifs a-t-il permis d’améliorer le rendement de la synthèse ?
Rendement = volume réel / volume théorique = 20,4 / 27,3 ~0,75 ( 75 %).
Un réactif en excès déplace l'équilibre dans le sens direct. Le
rendement est amélioré.
|
|
|
..............
.................
|
3. Synthèse de l’acétate d’isoamyle
par micro-ondes.
Les molécules d’eau absorbent le rayonnement de fréquence 2,45 GHz émis
par le four.
On réalise une deuxième synthèse, dans un four à micro-ondes, en
mettant en oeuvre le protocole expérimental suivant :
- Introduire, dans un erlenmeyer sec, un mélange équimolaire de 0,18
mol d’alcool isoamylique et
0,18 mol d’acide acétique. Ajouter 1 mL d’acide sulfurique concentré.
- Positionner l’erlenmeyer sur le bord du plateau tournant du four à
micro-ondes et l’irradier à une puissance de 800 W pour une durée
totale d’irradiation de 30 s.
- Laisser refroidir le mélange, puis procéder à une extraction
liquide-liquide.
- Filtrer et sécher pour récupérer l’ester.
Les conditions expérimentales de cette synthèse permettent d’obtenir un
rendement égal à 80 %.
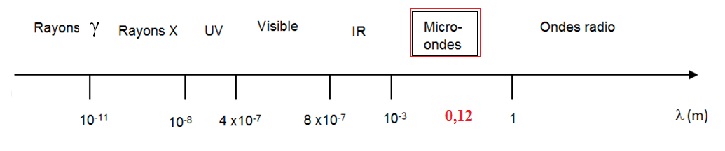
3.1. Justifier, en
utilisant le spectre des ondes électromagnétiques, que le four décrit
appartient à la catégorie des fours à micro-ondes.
l = c
/ f = 3,0 108 /(2,45 109) =0,12 m.
3.2. Déterminer la
valeur de l’énergie consommée par le four à micro-ondes lors de la
synthèse de l’acétate d’isoamyle, puis la comparer à l’énergie apportée
pour le chauffage à reflux et estimée à 270 kJ.
Puissance (W) x durée ( s) = 800 x30 = 2,4 104 J = 24 kJ.
Cette valeur est environ 11 fois plus faible que dans le cas du
chauffage à reflux.
3.3. Proposer une
interprétation, au niveau microscopique, du principe de chauffage par
micro-ondes.
Les molécules d'eau absorbent le rayonnement, ce qui entraîne une
agitation rapide des celles-ci..
3.4. Présenter des
arguments justifiant l’intérêt d’utiliser un four à micro-ondes, pour
cette synthèse, dans le cadre de la chimie verte.
Economie d'atomes : pour un rendement comparable, il n'est pas
nécessaire d'introduire un réactif en excès.
Economie d'énergie pour une même quantité d'ester formé.
|
|
|
|