Concours
technicien en technologie des biomolécules Rouen 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice1.
Un
produit ménager liquide déboucheur d'évier est constitué, entre autres,
d'hydroxyde de sodium aqueux. Sur l'étiquette figure le pourcentage
massique d'hydroxyde de sodium qui est de 20% ainsi que le pictogramme
suivant :
On souhaite vérifier l'indication portée sur l'étiquette grâce à un
titrage pHmétrique.
Le produit ménager étant très concentré, une dilution au 1/20ème
est effectuée afin d'obtenir une solution aqueuse diluée notée S.
1) Calculer le
volume V0 de produit ménager à prélever pour préparer un
volume V = 100,0 mL de solution S.
100 / 20 = 5,0 mL.
2) Parmi la liste
suivante choisir le matériel adapté pour cette dilution :
- pipette jaugée de 5,0 mL,
10,0 mL et 20,0 mL ;
- éprouvette graduée de 5 mL, 10 mL, 100 mL et 200 mL ;
- fiole jaugée de 50,0 mL, 100,0 mL et 200,0 mL.
On
prélève un volume V = 5,0 mL de la solution S auquel sont ajoutés 20 mL
d'eau distillée. Le mélange obtenu est titré avec une solution d'acide
chlorhydrique de concentration molaire cA = 0,10 mol/L. On
appelle VA le volume de la solution d'acide chlorhydrique
progressivement versé.
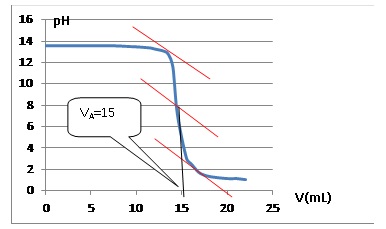
3) Tracer la courbe
pH = f(VA) et déterminer graphiquement le volume équivalent.
4) Ecrire
l'équation de la réaction support du titrage.
H3O+aq +HO-aq--> 2H2O(l).
Dans le tableau ci-dessous, figurent quelques indicateurs colorés et
leur zone de virage.
Hélianthine 3,1 ; 4,4 ; rouge de phénol 6,5 ; 8,4 ; phénolphtaléine 8,2
; 10,0.
5) Préciser l'indicateur le plus
approprié et justifier.
Le pH du point équivalent ( 8 dans ce cas) doit appartenir à la zone de
virage de l'indicateur coloré : rouge de phénol.
6) Calculer la
masse d'hydroxyde de sodium par litre de solution.
A l"quivalence : CAVA = CSV : CS
=CAVA
/ V = 0,10 x15 / 5,0 =0,30 mol/L.
Compte tenu de la dilution : C = 20 CS = 20 x0,30 = 6,0
mol/L.
M(NaOH) = 40 g/mol ; concentration massique : 6,0 x40 = 240 g /L.
7) Déterminer le
pourcentage massique d'hydroxyde de sodium dans le produit ménager.
Dans l'hypothèse où la densité de la solution est proche de 1,2,
pourcentage massique d'hydroxyde de sodium : 240 / 1200 x100 = 20 %.
8) Décrire la
procédure d’étalonnage avant la mesure du pH d’une solution ?
Réglage de la température.
Utiliser deux solutions tampons, par exemple de pH =9 et 7.
Placer la sonde de
mesure dans une solution tampon pH=7 : ajuster la lecture.placer la
sonde ( après rincage dans une solution tampon à pH=9 : régler la pente
en ajustant le pH.
9) Quels sont les
soins à
apporter lors de l’utilisation et du stockage d’une sonde de mesure du
pH, pour que celle-ci fonctionne bien et que la mesure soit
reproductible ?
Conservation de l'extrémité de la sonde dans l'eau distillée ( courte
durée) ou dans KCl 3M ( longue durée).
|
|
|
Exercice 2.
On donne le spectre RMN et le tableau ci-après :
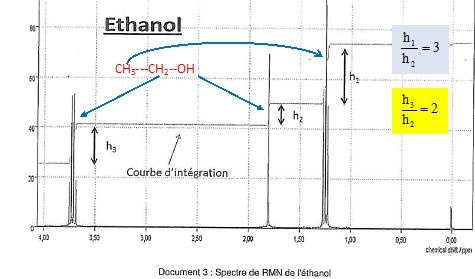
1) A quoi correspond l’acronyme RMN ?
Résonance magnétique nucléaire.
2) Quels sont les
principes physiques sur lesquels se fondent la RMN ?
Les spins nucléaires peuvent interagir avec un champ magnétique
extérieur. Les états de spin d'un noyau placé dans un champ magnétique
sont quantifiés. Pour le proton ( spin I = ½) il y a deux états
stationnaires possibles, correspondant au deux valeurs du nombre
quantique magnétique de spin ms =±½. Cette situation est
idéale pour la spectroscopie RMN. Un moment magnétique de spin peut
être assimilé à une aiguille aimantée microscopique.
En absence de champ magnétique extérieur, son orientation est
quelconque ; cela correspond à un seul niveau d'énergie. En présence
d'un champ magnétique extérieur, cette aiguille peut s'orienter
parallèlement au champ ( situation la plus stable) ou antiparallèlement
au champ. Deux niveaux d'énergie différents correspondent à cette
situation.( levée de dégénerescence ). La spectroscopie RMN consiste à
observer des transitions entre ces deux niveaux d'énergie.
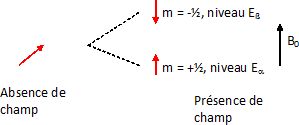
Proton isolé : les noyaux
dans l'état d'énergie Ea
peuvent absorber de l'énergie pour passer dans l'état Eß.
Cette énergie peut être apportée par une onde électromagnétique.
Proton lié une
molécule : le champ magnétique B régnant au niveau du noyau
diffère du champ extérieur B0.
B = B0(1-s).
s : constante
d'écran dépendant uniquement de l'environnemen chimique du noyau étudié.
Le déplacement chimique d = (sR-s)106 ppm est
indépendant de B0, donc du type d'appareil.
sR : déplacement
chimique servant de référence.
3) A quoi
correspond l’abréviation « TMS » indiquée sur le spectre?
Tétraméthylsilane
Si(CH3)4.
Pour apprécier le blindage subit par un proton, il faut une référence.
Les
12 protons équivalents du TMS présentent une absorption intense à des
champs plus forts que dans la plupart des autres protons. Le pic
correspondant est bien séparé à droite de l'enregistrement.
4) Ecrire la formule semi-développée
de l'éthanol.CH3-CH2-OH
5) Attribuer à
chaque groupe de protons équivalents les différents pics du spectre de
RMN de la molécule. ( voir ci-dessus).
6) Comment
s'applique la règle des (n + 1)-uplets : un proton ou un groupe de
protons équivalents ayant n protons voisins eux-mêmes équivalents
(portés par des atomes de carbone voisins) donne par couplage avec
ceux-ci un signal possédant (n + 1) pics. Ce signal est un multiplet.
Les trois protons du groupe CH3 ont 2 proches voisins,
protons équivalents, d'où un triplet.
Les deux protons du groupe CH2
ont 3 proches voisins, protons équivalents, d'où un quadruplet.
7) Préciser ce qu'indique la courbe
d'intégration des signaux.
Elle indique le nombre de proton dans chaque groupe de protons
équivalents.
|
|
|
|
Exercice
3.
On veut séparer un mélange de 3 acides-aminés : l'acide L-glutamique,
la Lleucine et la L-lysine par chromatographie sur une résine
polystyrénique
substituée par des groupements sulfonate (-SO3-). Les pH
isoélectriques de l'acide L-glutamique, de la L-leucine et de la
L-lysine sont respectivement : 3,22 ; 5,98 ; 9,74, à 25 °C.
On dépose le mélange sur la colonne, à pH 2, puis on élue en amenant
progressivement le pH à 7.
1) A quoi
correspond le « L » placé en préfixe des noms des acides aminés ?
Lévogyre : qui
a la propriété de faire dévier le plan de polarisation de la lumière
polarisée dans le sens inverse des aiguilles d’une montre. (vers la
gauche)
2) Définissez le
terme de pH isoélectrique ?
Le
pH isoélectrique correspond à une valeur particulière du pH d'une
solution d'acide aminé.
A cette valeur du pH ;
Comportement amphotère de la solution.
Grande solubilité de l'acide aminé dans l'eau.
Point isoélectrique :
pH pour lequel la charge totale de la molécule est nulle ; de plus les
concentrations des formes AH2+ et A- sont identiques.
3) Comment
s’appelle cette technique de chromatographie ?
Chromatographie échangeuse d'ions. La résine est chargée négativement. C'est une résine échangeuse de cations.
4) Précisez l’ordre
d’élution des acides aminés (On considérera que les interactions acide
aminé-résine sont uniquement d'ordre électrostatique).
Lorsdque le pH est supérieur au pHi, l'acide est chargé négativement ( forme anionique ).
Lorsdque le pH est inférieur au pHi, l'acide est chargé positivement ( forme cathionique ).
A pH = 2, les trois acides sont chargés positivement et seront retenus lors du passage sur la colonne.
A pH =7, les acides L-glutamique et de la L-leucine sont chargés négativement : ils seront élués.
L'acide L-glutamique est élué en premier ( pHi = 3,22), puis l'acide de la L-lysine ( pHi=5,98)
5) Le pKa1
de la L-leucine est de 2,36 mais quelle est la valeur de son pKa2
?
pHisoélectrique = 0,5(pKa1 +pKa2) ; pKa2
= 2pHisoélectrique -pKa1 =2x5,98 -2,36 = 9,6.
6) L’acide
aspartique est un acide aminé de pKa1=1,88, pKa2=9,60
et pKa3=3,65 (la chaine latérale de cet acide aminé comporte
une fonction acide carboxylique).
7) En quelle
position serait-il élué de la colonne si on l’ajoutait au mélange des 3
acides aminés?
pHi = 0,5(1,88 +3,65) =2,76. L'acide aspartique serait élué en premier.
Exercice 5.
Dans le cadre de votre mission d’enseignement,
vous avez à
préparer et organiser une séance de travaux pratiques intitulée : «
Extraction et séparation de quelques pigments végétaux ».
Les étudiants devront tout d’abord extraire les pigments de feuilles
d’épinard par broyage dans de l’acétone. Les pigments chlorophylliens
présentent une solubilité différentielle dans divers solvants non
miscibles. Ainsi, il est simple de les séparer à l’aide d’une ampoule à
décanter.
Pour cela, plusieurs mélanges d’extraction seront utilisés
successivement :
- Ether de pétrole et acétone
- Ether de pétrole et méthanol à 85%
- potasse méthanolée et ether de pétrole
Un dosage spectrophotométrique sera finalement effectué.
1) Quelles
précautions les étudiants devront-ils prendre pour réaliser ce TP dans
de bonnes conditions d’hygiène et de sécurité (justifiez) ?
L'acétone est nocive et inflammable ; le métanol est inflammable,
toxique et cancèrigène, l'éther de pétrole est inflammable et
cancèrigène, la potasse est corrosive : port de blouse, gants et
lunettes de protection. Travail sous hotte aspirante en absence de
toute flamme.
3) Faire un schéma
d’une ampoule à décanter.
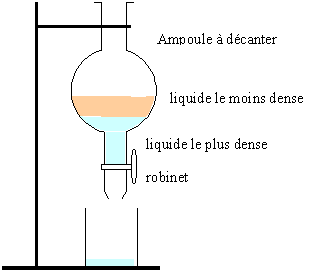
4) Expliquer le
principe d’une extraction liquide-liquide.
L'espèce à extraire doit être très soluble dans un solvant et peu
soluble dans l'autre solvant. Les deux solvants ne doivent pas être
miscibles et possèder des densités différentes.
Voici ci-dessous les spectres d’absorption des chlorophylles a et b.
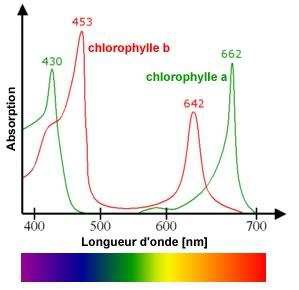
5) Peut-on
expliquer la couleur verte des épinards ?
La couleur complémentaire du vert est le magenta : Les
chlorophylles a et b présenntent un maximum d'absorption dans le bleu (
vers 450 nm ) et dans le rouge ( vers 650 nm).
6) Comment
pourrait-on déterminer les quantités relatives de chlorophylles a et b
dans les feuilles d’épinard?
Vers 490 nm, la chlorophylle b présente un maximum d'absorption alors
que l'absorption de la chlorophylle a est nulle.
Vers 662 nm, la chlorophylle a présente un maximum d'absorption alors
que l'absorption de la chlorophylle b est nulle.
Spectrophotométrie en se plaçant à ses deux longueurs d'onde.
7) Quelle technique
de séparation peut-on utiliser ?
Extraction liquide liquide : les pigments chlorophylliens présentent
une solubilité différentielle dans divers solvants non miscibles.
|
|
|
|
Exercice 6.
1) En cas de projection sur la peau
d’acide ou de produits corrosifs, que doit-on faire ?
Laver à grande eau.
2) Avant
l’utilisation d’un flacon, d’une bouteille, que faites-vous ?
Sur l'étiquette, lire les pictogrammes de risques et les consignes de
sécurité.
3) On se débarrasse
des petits morceaux de sodium non utilisés après une expérience :
- En les jetant dans l’eau ?
- En les jetant dans l’alcool ?
- En les laissant brûler ?
4) Quelles sont les
définitions de EPI et EPC ? Donner un exemple pour chacun.
Equipement de protection individuelle : blouse, lunette et gants.
Equipement de protection collective : extincteur, douche.
Exercice 7.
Lors d’un dosage colorimétrique de protéines (méthode de Lowry) vous
obtenez les résultats suivants :
n°
tube
|
1
|
2
|
3
|
4
|
5
|
X1
|
X2
|
mL
de SM
|
0,0
|
0,25
|
0,50
|
0,75
|
1,00
|
|
|
mL
solvant
|
1,0
|
0,75
|
0,50
|
0,25
|
0
|
0
|
0,50
|
Concentration
protèines ( mg/L)
|
0
|
25
|
50
|
75
|
100
|
|
|
DO
à 750 nm
|
0,0
|
0,14
|
0,31
|
0,57
|
0,64
|
0,46
|
0,21
|
X1 : solution protéique inconnue ; X2 = X1
diluée au demi.
La solution mère (SM) de Sérum Albumine Bovine est préparée à une
concentration de 0,1 mg/mL.
En vous basant sur ces résultats :
1) Rappelez la loi
de Beer-Lambert en précisant la signification de chaque terme;
A = e l c.
A : absorbance ; e
: coefficient
d'absorbance (L mol-1 cm-1)
; l est l'épaisseur de la cuve (cm)
et c la concentration de la
solution (mol/L).
2) Complétez le
tableau et donnez un exemple de calcul ;
0,25 x 0,1 / (0,25 +0,75) = 0,025 mg / mL = 25 mg/L.
3) Quel est le rôle
du tube 1 ?
Faire le blanc, référence ( A=0) pour l'absorbance en présence du
solvant seul.
4) Pourquoi
l’inconnu possède-t-il 2 tubes ?
Pour des concentrations trop élevées, l'absorbance et la concentration
ne sont pas proportionnelles.
5) Déterminez la
concentration de la solution protéique.
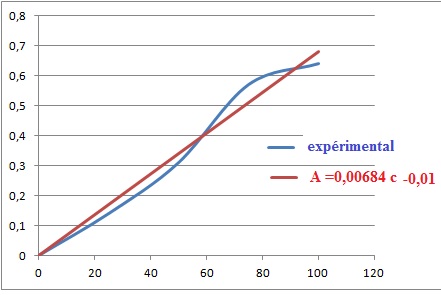
X1 : c1 =( 0,46 +0,01) / 0,00684 ~69 mg/L.
X2 : c2 =( 0,21 +0,01) / 0,00684 ~32 mg/L d'où c1
= 2 x32 = 64 mg /L.
|
|






