Chimie
analytique, concours externe technicien principal de la police
technique et scientifique
2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
Partie 1 : synthèse et caractérisation du luminol.
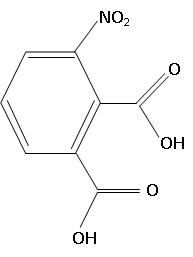
1. Ecrire la formule topologique de l'acide 3-nitrobenzène-1, 2-dicarboxylique.
Le luminol ( 3-aminophthalhyrrazide C8H7N3O2 ) a été synthétisé pour la première fois en faisant réagir l'hydrazine N2H4
avec l'acide 3-nitrobenzène-1,2-dicarboxylique lors d'une réaction de
condensation / déshydratation. Puis il suffit de réduire le groupement
nitro en ajoutant dans le milieu réactionnel de l'hydrosulfite de
sodium Na2 S2O4 pour obtenir l'amine correspondante.
2. Ecrire le mécanisme réactionnel proposé en faisant apparaître le mouvement des électrons.
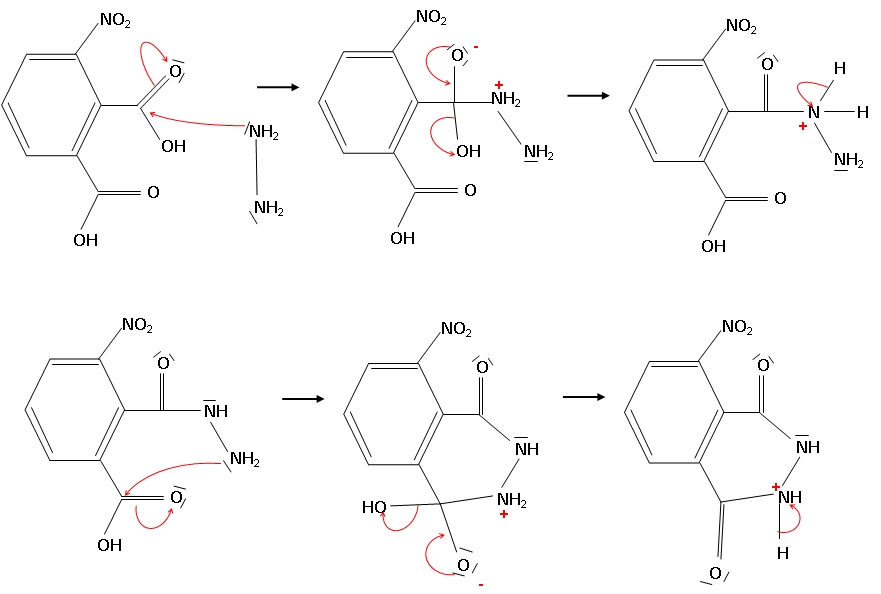
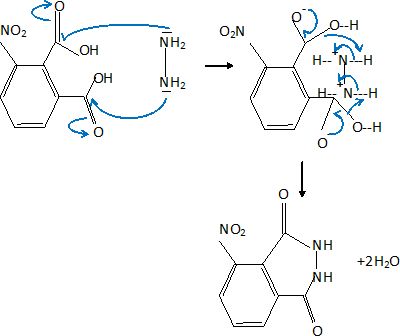 3.
Des chercheurs ont synthétisé du luminol à partir de 1,0024 g d'acide
3-nitrobenzène-1,2-dicarboxylique et de 2 mL de solution aqueuse
d'hydrazine à 8 % ( densité =1). Ils ont ensuite ajouté 2,510 g
d'hydrosulfite de sodium et ont obtenu un rendement de 35 %. Après
avoir identifié le réactif limitant, déterminer la masse de luminol
synthétisé.
3.
Des chercheurs ont synthétisé du luminol à partir de 1,0024 g d'acide
3-nitrobenzène-1,2-dicarboxylique et de 2 mL de solution aqueuse
d'hydrazine à 8 % ( densité =1). Ils ont ensuite ajouté 2,510 g
d'hydrosulfite de sodium et ont obtenu un rendement de 35 %. Après
avoir identifié le réactif limitant, déterminer la masse de luminol
synthétisé.
M(acide C8H5O6N) = 8x12 +5 +6x16 +14=211 g/mol ; N(N2H4) =32 g/mol.
M(luminol C8H7O2N3) = 8x12 +7 +2x16 +14x3=177 g/mol
n(acide C8H5O4N) = 1,0024 / 211 = 0,00475 mol.
n(N2H4) =2x0,08 / 32 = 0,005 mol ; l'hydrazine est en excès.
Masse théorique de luminol : 0,00475 x177 = 0,84075 g.
En tenant compte du rendement : 0,84075 x0,35 = 0,2943 g.
4.
Les chercheurs réalisent une analyse RMN du proton à 400 MHz qui révèle
la présence de 5 signaux. Compléter le tableau suivant :
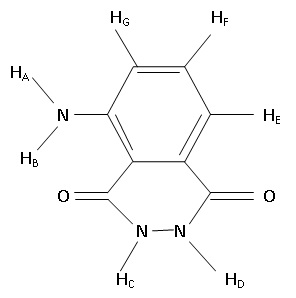
|
Signal ppm
|
Nombre de protons
| Multiplicité
|
Protons associés
|
11,2
|
2
|
singulet
|
C et D
|
7,49
|
1
|
triplet
|
F
|
7,36
|
2
| singulet
|
A et B
|
6,999
|
1
| doublet
|
E
|
6,939
|
1
|
doublet |
G
|
5. Une
seconde analyse type GC/MS est alors réalisée. Celle-ci révèle en
isotherme la présence de deux pics mal résolus ; l'identification du
premier via son spectre de masse confirme qu'il s'agit bien du luminol.
5a. Que signifie GC dans GC / MS ? Rappeler le principe de cette méthode séparative.
Gas chromatography-mass spectrometry.
Un
fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A
l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De
ce phénomène appelé rétention il résulte que les constituants du
mélange injecté se déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de
la colonne les uns après les autres et donc séparés.
Un
détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic.
5b. Sur quel(s)
paramètre(s) expérimental (aux) peut-on jouer pour améliorer la
séparation de 2 pics co-élués sans modifier la colonne ni le ratio de
split ?
Température, débit du gaz vecteur.
5c. Qu'est ce qu'une injection en mode split ?
Les injecteurs peuvent fonctionner suivant deux modes, avec ou sans division (encore appelés split ou splitless).
En
mode split, le gaz vecteur pénètre avec un grand débit dans la chambre
de vaporisation ; une vanne de fuite sépare le courant gazeux en deux
parties : seule la plus petite pénétre dans la colonne. Ce
mode est utilisé dans les colonnes capillaires à faible débit. Le mode
splitless est utilisé dans le cas d'échantillons très dilués.
5d. Quels sont les éléments qui constituent un spectromètre de masse ?
Source d'ion : production d'ions en phase gazeuse.
Analyseur m / z : séparation des ions produits en fonction du rapport masse / charge ( m / z).
Détection : conversion d'un courant ionique en courant électrique.
Traitement du signal : représentation des données sous forme d'un spectre de masse.
5e. A quoi correspondent
les pics177,0, 178,0 et 91,0 donnés dans le spectre de masse ci-dessous
?
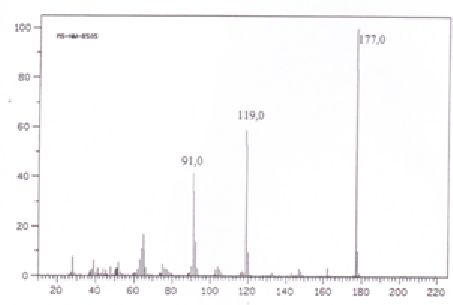
M =177 : pic moléculaire.
178 soit M+1. Il prend en compte les abondances relatives des isotopes de l'azote et du carbone.
Pour une molécule contenant x atomes de carbone et t atomes d'azote : 100 (M+1) / M =1,1 x +0,36 t = 1,1 x8+0,36 x3 ~10 %.
91 : C6H5-N.
5f. Quel autre type de détecteur aurions nous pu utiliser ?
Les catharomètres sont basés sur la conductibilité thermique des gaz. Ils sont peu sensibles ( de l'ordre de 1 à 10 ng).
Les
FID ( détecteur à ionisation de flamme) sont très sensibles ( de 20 à
100 pg). Ils ne conviennent pas aux composés inorganiques.
A capture d'électrons, bien adaptés aux composés halogénés.
|
|
|
La réaction de chimiluminescence.
1. Quelle est l'énergie en eV transportée par un photon émis lors de la réaction de chimiluminescence du luminol ?
L'oxydation du luminol en milieu alcalin conduit à l'émission de photons de longueur d'onde de 450 nm.
E = h c / l = 6,63 10-34 x3 108 / (450 10-9)=4,42 10-19 J ou 4,42 10-19 / (1,6 10-19) = 2,76 eV.
2.Quel
est le rôle du fer dans cette précédente réaction ? Comment peut-on
alors qualifier cette espèce chimique dans ce cas bien précis ?
La
réaction de chimiluminescence est très lente ; elle peut être accélérée
en présence d'un métal de transition comme le fer(II) de l'hémoglobine
sanguin. Le fer (II) joue le rôle de catalyseur.
3. Quel est le gaz qui se dégage durant la réaction de chimiluminescence ?
Le diazote N2.
4.
"Lorsque l'enquéteur utilise le bluestar, des faux positifs peuvent
l'induire en erreur notamment lorsque le cuivre est présent". Commentez
cette phrase puis expliquer simplement pourquoi le cuivre peut donner
des faux positifs.
Le luminol réagit en
présence de cuivre ( ou d'un alliage de cuivre) de sodium ( contenu
dans l'eau de Javel), de décolorants, de vernis.
L'eau oxygénée.
Dosage volumétrique.
1.a Ecrire les demi-équations électroniques relatives à chacun des couples de l'eau oxygénée. Que peut-on dire de H2O2 ?
O2(g) / H2O2 aq : H2O2 aq = O2(g) + 2e- +2H+aq. Oxydation.
H2O2aq / H2O(l) : H2O2 aq + 2e- +2H+aq= 2H2O(l). Réduction.
2 H2O2 aq = O2(g) + 2H2O(l). Dismutation.
L'eau oxygénée peut jouer le rôle d'oxydant et le rôle de réducteur.
1.b. Compléter le diagrame E-pH de H2O2 en indiquant les espèces présentes dans chaque domaine.
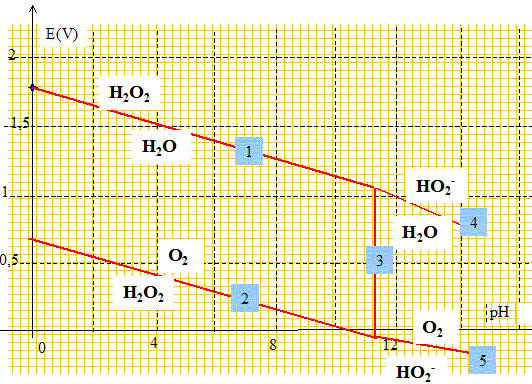
1.c. Que peut-on dire de la stabilité de l'eau oxygénée ? Justifier.
L'eau oxygénée va se
dismuter en O2 et H2O.
2. Par définition 1 L d'eau oxygénée à 10 volumes libère 10 L de dioxygène à 0°C et 1 atm. La concentration molaire de H2O2 dans cette solution est de 0,893 M. Justifier par un calcul.
H2O2 = ½O2 +
H2O d'où n(H2O2) = 2
n(O2) =2 *10/22,4 = 0,893
mol dans 1 L.
3.
On procède à l'étalonnage de la solution à 10 volumes précédente diluée
10 fois en la titrant par une solution de permanganate de potassium à
0,025 M en milieu acide..
3.a. Ecrire l'équation de la réaction entre l'eau oxygénée et le permanganate.
MnO4-/Mn2+ :
E° = 1,51 V. 2 fois
{MnO4- + 8H+
+5e- =Mn2++
4H2O}
O2 / H2O2
: E° = 0,69 V. 5 fois
{ H2O2 =
O2 + 2H+
+2e-}
2 MnO4- + 6H+
+5H2O2 --> 2 Mn2++
5O2 +8H2O
3.b.Comment repère t-on l'équivalence du dosage ?
La seule espèce colorée est l'ion
permanganate ( violet) ; avant l'équivalence, dans le
bécher, l'ion permanganate est en défaut : la
solution est incolore.
Après l'équivalence l'ion permanganate est
en excès : la solution devient rose violette.
4.
Calculer la concentration en mol/L de la solution d'eau oxygénée à 10
volumes sachant que le volume de solution dosée est V = 10,0 mL et que
le volume de permanganate versé à l'équivalence est Véq = 13,00 mL. Conclure.
n( H2O2) = 2,5
n(MnO4-) = 2,5 * 13,0 10-3
*0,025 = 8,125 10-4 mol.
[H2O2] = 8,125
10-4 /0,010 = 8,13
10-2 mol/L.
[H2O2]
mère= 10 * 8,13 10-2 = 0,813
mol/L.
La
solution mère n'a pas été fraichement
préparée et la dismutation de l'eau
oxygénée est avancée.
5. Ce dosage peut être suivi par potentiométrie. Quelles sont les électrodes à utiliser ?
L'électrode de référence
utilisée ici est une électrode au calomel
saturée (ECS), c'est à dire une
électrode de platine (Pt) recouverte de mercure (Hg)
sur lequel est déposé du calomel
Hg2Cl2. Cette électrode est
dite saturée car la solution dans laquelle plonge
l'électrode ainsi constituée est une solution
aqueuse saturée en chlorure de potassium KCl. Une
électrode de mesure en platine par exemple.
Dosage spectrophotométrique.
La réaction de dosage de l'eau oxygénée par le permanganate de
potassium est suivie par spectrophotométrie UV/visible, en mesurant
l'absorbance à la longueur d'onde 520 nm, en fonction du volume de
permanganate versé.
1. Définir mathématiquement l'absorbance en précisant le sens de chaque terme.
2. Enoncer la loi de Beer Lambert en précisant le nom de chaque grandeur et leur unité.
Lorsqu'une lumière monochromatique d'intensité I0 traverse
un milieu homogène, l'intensité de la lumière émergente I décroît
exponentiellement lorsque l'épaisseur l du milieu absorbant augmente.
I = I0 . e (- al)
a est une constante appelée coefficient d'absorption, caractéristique du milieu et de la longueur d'onde considérés.
La relation fondamentale utilisée en spectrophotométrie est présentée sous la forme :
A= log (I0/I) = elc ( A est l'absorbance ou densité optique)
Cette loi de Beer est vérifiée lorsque la solution est de concentration inférieure à : c < 0,1 mol.L-1.
e est un coefficient caractéristique de la substance appelé coefficient d'absorbance (L mol-1 cm-1), l est l'épaisseur de la cuve (cm) et c la concentration de la solution (mol/L).
3. Comment a été choisie la longueur d'onde de travail ?
Pour une meilleure précision, l'espèce colorée doit présenter un maximum d'absorption à la longueur d'onde de travail.
4. Etablir un lien entre cette longueur d'onde de travail et la couleur de la solution.
La solution de premanganate de potassium est rouge pourpre. La couleur
absorbée est la teinte complémentaire du rouge pourpre, donc le vert. (
500 nm - 560 nm).
5. Parmi ces deux
lampes, laquelle choisiriez-vous pour réaliser ce dosage : une lampe à
deutérium ou une lampe à filament de tungstène ? Quel dispositif
faudra-t-il ajouter ?
Lampe à filament de tungstène : lumière blanche pour des mesures dans le visible.
Le monochromateur formé d'un réseau diffractant la lumière de la source
permet d'isoler le rayonnement sur lequel on fait la mesure.
|
|
|
|
QCM.
2. Lors d'un étalonnage interne en chromatographie en phase gazeuse, l'étalon choisi doit :
- Avoir des propriétés physico-chimiques proches de celle de l'analyte. Vrai.
- Etre présent dans l'échantillon de départ. Faux.
- être thermolabile. Faux.
3. Pour prouver qualitativement la présence d'un halogénure en solution on ajoute :
- de la soude. Faux.
- de l'oxalate de sodium. Faux.
- du nitrate d'argent. Vrai.
- du picrate de sodium. Faux.
4. La tyrosine comporte une fonction : 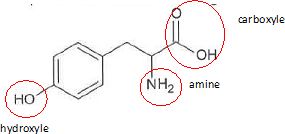
- aldehyde. Faux.
- acide . Vrai.
-amide. Faux.
- amine. Vrai.
- cétone. Faux.
5. Si on dose par
la soude un diacide dont les pKa1 et pKa2 sont 7,2 et 12
respectivement, combien de saut de pH va t-on observer ?
0 ; 1 ( vrai) ; 2 ; 3.
6. On suit à 25°C
un dosage en mesurant la différence de potentiel entre une électrode de
platine et une électrode de référence de type ECS. On lit initialement
une valeur de 0,4 V. Que vaut cette valeur par rapport à l'électrode
normale à hydrogène sachant que E°(Hg2Cl2 /Hg) = 0,27 V / ENH et que la concentration en ion chlorure est de 3 M.
0,64 V (vrai) ; 0,67 V ; 0,16 V ; 0,13 V.
couple Hg2Cl2 (s)/ Hg (l) : Hg2Cl2 (s)+ 2e- =2 Hg(l) + 2Cl-.
Eréf = E°[ Hg2Cl2 (s)/ Hg (l)] + 0,03 log 1/[Cl-]2.
Eréf = 0,27 -0,06 log [Cl-] = 0,27 -0,06 log 3 = 0,24 V / ENH.
7.. En chromatographie de partage avec une colonne de type C18 :
- la phase stationnaire est apolaire. Vrai
- la phase stationnaire est polaire. Faux.
- la phase stationnaire est ionique. Faux.
8. En chromatographie en phase gazeuse, l'utilisation du mode headspace fait appel à la loi :
de Beer Lambert ; de Henry (vrai); de Nernst ; de Kepler.
9. La limite de détection est :
- fonction de l'analyte considéré et de la méthode analytique utilisée.
- vaut classiquement 3 fois le rapport S/N.
- vaut classiquement 10 fois le rapport S/N.
- donne la plus petite valeur de concentration mesurable. Vrai.
- une valeur au dessous de laquelle on ne peut pas affirmer que l'analyte est présent dans l'échantillon.
- une valeur au dessous de laquelle on ne peut pas affirmer que l'analyte est absent dans l'échantillon.
10. Parmi les composés suivants laquel (lesquels) fait ( font) apparaître au moins un élément stéréogène.
2-bromopropane
3-méthylbut-1-ène
3-méthylbutane
3-méthylpent-2-ène. Vrai.
2,3-dibromobutane. Vrai.
|
|
|






