Economiser
de l'énergie en recyclant les canettes en aluminium, bac S Nlle
Calédonie
2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
......
.....
|
L’aluminium utilisé pour
fabriquer les canettes de boissons peut avoir deux origines.
Il s’agit soit d’aluminium dit « de première fusion » produit à partir
d’un minerai appelé bauxite, soit d’aluminium dit « de deuxième fusion » obtenu par
recyclage des canettes usagées.
Pour encourager à recycler ces canettes, un site internet avance que «
recycler une seule canette économise autant d’énergie que la consommation
énergétique d’une télévision pendant 3 heures. »
Le but de cet exercice est de vérifier si cette affirmation est exacte
en se limitant à certains aspects de la production et du recyclage des canettes.
Données :
masse d’une canette en aluminium vide : m = 13,3 g ;
quelques grandeurs caractéristiques de l’aluminium :
Masse molaire atomique (27,0 g.mol-1)
Capacité thermique massique à l’état solide cs =9,0 102 J.kg-1.K-1.
Capacité thermique massique à l’état liquide cl =1,09 103 J.kg-1.K-1.
Questions préliminaires
1. Soit Q la charge totale échangée au cours d’une électrolyse et Uél la tension électrique aux bornes de l’électrolyseur, montrer que l’énergie électrique Eélectrolyse consommée lors de cette électrolyse a pour expression Eélectrolyse = Q.Uél.
Puissance P consommée par un récepteur électrique : P = Uél.I où Uél est la tension aux bornes du récepteur électrique et I l’intensité du courant qui traverse le récepteur.
L’intensité I du courant électrique s’exprime en fonction de la charge
électrique Q échangée pendant une durée Δt et de la durée Δt par la
relation : I = Q / Δt.
Eélectrolyse = P Δt = Uél.I Δt = Q.Uél.
2.
Calculer l’énergie utile correspondant à la variation d’énergie interne
ΔU nécessaire à l’élévation de température entre 20 °C et 660 °C d’une
masse de 1,0 kg d’aluminium solide.
DU = m cs (qfin - qinit) = 1,0 x 9,0 102 x(660-20) =5,76 105 ~5,8 105 J.
Problème.
Montrer que l’énergie totale consommée pour le recyclage d’une canette
peut être considérée comme très inférieure à l’énergie totale consommée
lors de la fabrication de cette canette à partir de la bauxite.
Commenter alors l’information selon laquelle recycler une canette,
plutôt que de la fabriquer à partir de la bauxite, permet d’économiser
l’énergie nécessaire au fonctionnement d’une « télévision pendant 3
heures ».
Production de l’aluminium à partir de la bauxite.
L’aluminium se trouve dans la nature sous forme d’alumine Al2O3, solide présent dans un minerai appelé bauxite. L’extraction et la dissolution de l’alumine dans un bain fluoré permet d’obtenir de l’oxyde d’aluminium dissous sous forme ionique (2 Al3+ + 3 O2-). L’aluminium métallique Al est obtenu par électrolyse de l’oxyde d’aluminium dissous selon le processus schématisé ci-dessous.
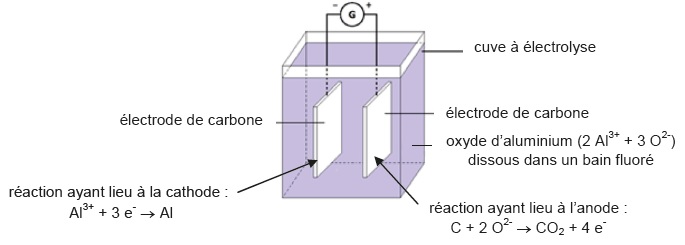
Le
générateur produit le courant électrique et provoque le déplacement
d’électrons entre l’anode et la cathode. Cette électrolyse est un
procédé très consommateur en énergie électrique.
La tension imposée entre les électrodes de la cuve à électrolyse est Uél = 4,5 V.
Pour 1 kg d'aluminium :
Quantité de matière d'aluminium n = 1000 / 27 ~37,0 mol.
Quantité de matière d'électron : 3n = 111,1 mol.
Une mole d’électrons possède une charge électrique égale à 9,65 × 104 C en valeur
Q= 111,1 x9,65 104 =1,07 107 C.
Eélectrolyse = Uél Q = 4,5 x1,07 107 = 4,8 107 J.
On peut estimer que l’énergie électrique nécessaire pour la réaction
d’électrolyse représente 20 % de l’énergie totale consommée pour la
synthèse de l’aluminium à partir de la bauxite.
Etotale = 5 x4,8 107~2,4 108 J.
Energie totale consommée pour fabriquer une canette de masse 13,3 g à partir de la bauxite :
2,4 108 x 13,3 10-3 = 3,2 106 J.
|
...
|
|
|
....
|
L’aluminium de deuxième fusion : recyclage des canettes.
Après leur récupération, les canettes en aluminium sont comprimées dans
une presse avant d’être acheminées vers des fonderies de recyclage.
Dans des fours, l’aluminium passe de la température ambiante à une
température de 720 °C. Durant ce processus, l’aluminium fond lorsqu’il
atteint la température de fusion (Tf = 660 °C).
Variation
d’énergie interne ΔU nécessaire à l’élévation de température entre 20
°C et 660 °C d’une masse de 1,0 kg d’aluminium solide.
DU = m cs (qfin - qinit) = 1,0 x 9,0 102 x(660-20) =5,76 105 ~5,8 105 J.
Energie nécessaire à la fusion de 1 kg de canettes : 4,0 105 J.
Energie pour élever le liquide de 660 à 720 °C : 6,5 104 J.
Total : 1,05 106 J kg-1.
Dans le cas du recyclage des canettes, le rendement énergétique du
processus de « deuxième fusion » est d’environ 45 %, principalement en
raison des pertes thermiques dans les fours.
Energie totale tenant compte du rendement : 1,05 106 / 0,45 =2,3 106 J kg-1.
Soit pour une canette : 2,3 106 x13,3 10-3 = 3,1 104 J.
C'est à dire environ 100 fois moins énergétique que le processus par électrolyse de l'oxyde d'aluminium.
Energie nécessaire au fonctionnement d'une télévision plasma ( P = 287 W) pendant 3 heures.
287 x3 x3600 ~3,1 106 J.
Différence d'énergie entre les deux processus de fabrication d'une canette :
3,2 106 -3,1 104 ~3,2 106 J.
L'information «
recycler une seule canette économise autant d’énergie que la consommation
énergétique d’une télévision pendant 3 heures. » est correcte.
|
|
