L'acide
cinnamique, Bac S Inde 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
1. Etude de la molécule.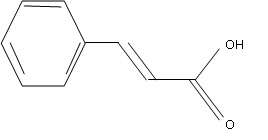
1.1.
Vérifier la valeur de la masse molaire de l'acide cinnamique ( M = 148
g / mol). Quel est son état physique à température ambiante ? Justifier.
M(C9H8O2) = 12 x9 +8 +2 x16 = 148 g/mol.
Tfusion = 135°C. A température ambiante, l'acide cinnamique se trouve à l'état solide.
1.2. Entourer le groupe caractéristique et nommer le.
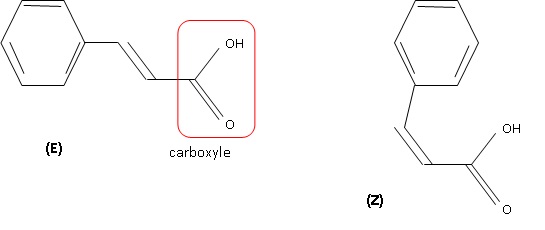
1.3. Représenter la formule topologique de son stéréoisomère et nommer le type de stéréoisomérie.
Diastéréoisomérie de type Z E due à la présence de la double liaison carbone - carbone.
2. Synthèse de l'acide cinnamique au laboratoire à partir du benzaldehyde et de l'acide malonique.
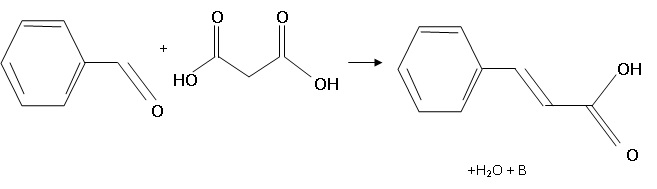
Dans un ballon, introduire 25,0 g d'acide malonique ( M = 104
g/mol), 10,0 mL de benzaldehyde ( M = 106 g/mol, densité 1,04 ), en
présence de bêta-alanine et de pyridine. Placer un barreau aimanté.
Chauffer à reflux et agiter pendant une heure et demie.
Laisser refroidir, ajouter 130 mL d'eau froide puis de l'acide
chlorhydrique concentré pour amener la valeur du pH à 1. L'acide
cinnamique précipite.
2.1 Déterminer la formule brute de B.
CO2.
2.2. Choisir le nom en nomenclature officielle de l'acide malonique parmi :
acide 2-méthylepropanoïque ; acide propanedioïque ( exact) ; acide 3-hydroxypropanoïque.
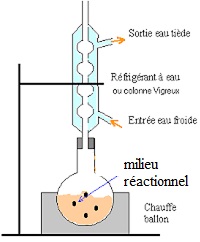
2.3. Faire un schéma légendé du montage utilisé.
|
|
|
Dans l'une des étapes de la synthèse, la pyridine réagit avec l'acide cinnamique dès sa formation suivant :
C6H5-CH=CHCOOH + C5H5N --> C6H5-CH=CHCOO- + C5H5NH+.
2.4. Quelle est la nature de la réaction ? Justifier.
Réaction acide base : échange de proton entre l'acide cinnamique et la base pyridine.
2.5. Proposer une justification pour expliquer l'apparition d'un précipité d'acide cinnamique ( pKa = 4,4) lors de l'ajout d'acide chlorhydrique.
A pH inférieur à pKa, la forme acide C6H5-CH=CHCOOH prédomine ; or ce dernier est très peu soluble dans l'eau. L'acide cinamique précipite.
2.6. Proposer une méthode de récupération de l'acide cinnamique.
Filtration sous vide partiel.
2.7. Les étudiants ont obtenu 11,6 g d'acide cinnamique. Déterminer la valeur du rendement de la réaction.
Quantité de matière :
acide malonique : 25,0 / 104 = 0,2404 mol.
benzaldehyde : 10,0 x1,04 / 106 = 0,0981 ( en défaut).
acide cinnamique ( en cas de réaction est totale) : 0,0981 mol soit 0,0981 x148 ~ 14,5 g.
Rendement = masse réelle / masse théorique = 11,6 / 14,5 ~0,80 ( 80 %).
|
|
|
|
Extraction de l'acide cinnamique du xuan shen.
La teneur moyenne en acide cinnamique
dans le xuan shen est de 0,35 mg pour 1 g de végétaux. On fait
l'hypothèse que le rendement de l'extraction de l'acide cinnamique est
de 80 %. Estimer la masse de xuan shen nécessaire pour obtenir 10 g
d'acide cinnamique.
Dans l'hypothèse d'un rendement de 100 % lors de l'extraction, il faut :10 /(0,35 10-3) = 28 571 g ~28,57 kg de xuan shen.
En tenant compte du rendement : 28,571 / 0,80 ~35,7 soit 36 kg de xuan shen.
|
|
|