La plongée en
apnée ; l'aspirine ; la tyrosine, Bac ST2S métropole 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
Exercice
1.
Un
apnéiste effectue une descente de 110 m de profondeur. Il est muni d'un
cardiofréquencemètre. Au début de la descente, la fréquence cardiaque
augmente car le plongeur consomme une partie du dioxygène qu'il a
stocké pour s'immerger. Elle chute ensuite très progressivement jusqu'à
se stabiliser.
A son retour, il se plaint de douleurs aux tympans.
Les
graphes ci-dessous permettent de visualiser les variations de la
fréquence cardiaque du plongeur et la pression en fonction de la
profondeur.
1.1. Extraire la
valeur de la fréquence cardiaque du plongeur en battements par minute
lorsqu'il atteint la profondeur de 110 m.
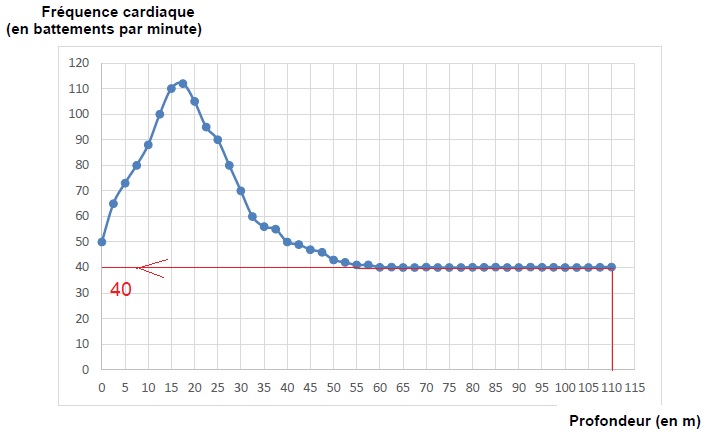
Dans ces conditions, chaque battement cardiaque envoie 7,0 10-2
L de sang dans l'aorte.
1.2. Calculer à
cette profondeur le volume de sang circulant dans l'aorte chaque minute.
40 x7,0 10-2 = 2,8 L.
Le débit volumique du sang dans l'aorte est égal à D =4,7 10-5
m3 s-1.
1.3. Calculer la
vitesse du sang dans l'aorte de section S = 2,5 10-4 m2.
v = D / S = 4,7 10-5 / (2,5 10-4) =0,188 ~0,19 m s-1.
2. Etude de la pression loors de la
plongée.
2.1. Déterminer la
valeur de la pression lorsque le plongeur atteint la profondeur de 110
m.
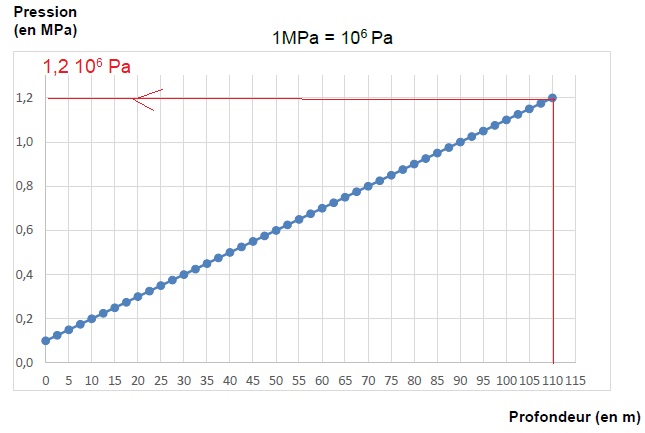
2.2. Citer le nom
de l'appareil permettant de mesurer la pression.
Le manomètre, le pressiomètre.
2.3. Un tympan a
une surface S = 5,0 10-5 m2. Calculer la valeur
de la force qui s'exerce sur la face externe du tympan à cette
profondeur.
F = P S = 1,2 106 x5,0 10-5 = 60 N.
2.4 Calculer la
valeur de la force exercée sur le tympan du plongeur à son retour à la
surface.
F = Patm
S = 1,0 105 x5,0 10-5 = 5 N.
2.5. Proposer une
explication aux douleurs de l'ampnéiste en eau profonde.
A 110 m de profondeur, la force qui s'exerce sur le tympan est 12 fois
plus importante qu'en surface.
|
|
|
|
|
L'aspirine.
1. Etude d'une
solution d'aspirine.
On dissout un cachet préalablement broyé dans de l'eau distilée
afin d'obtenir un volume V = 200 mL de solution notée S.
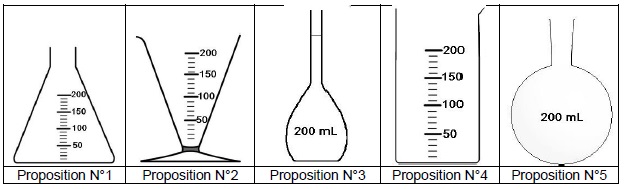
1.1. Choisir et
nommer la verrerie nécessaire pour mesurer le volume de la solution S
avec le maximum de précision.
Fiole jaugée de 200 mL.
L'aspirine de formule brute C9H8O4 est
une espèce chimique acide.
1.2. Donner la
définition d'un acide selon Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un
proton H+.
L'aspirine possède une base conjuguée, l'ion acéthylsalicylate C9H7O4-.
Le pKa de ce couple acide base est 3,5.
1.3. Construire le
diagramme de prédominance des espèces chimiques de ce couple.
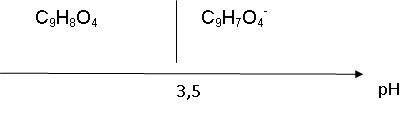
1.4. Déterminer
l'espèce chimique prédominante dans la solution S de pH = 2,5.
A pH inférieur à pKa, la forme acide C9H8O4
prédomine.
1.5. Vous prélevez
avec précision, un volume Va = 10,0 mL de la solution S.
Indiquer la position correcte de votre oeil.
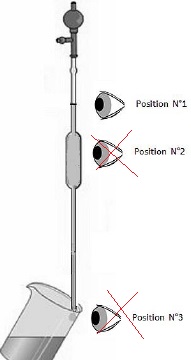
|
|
.2.
Le dosage de l'aspirine.
On réalise un dosage pHmétrique de l'aspirine contenue dans un volume Va
= 10,0 mL de la solution S. la solution titrante est une solution de
soude de concentration cB =1,5 10-2 mol /L.
2.1. Réaliser sur
votre copie un schéma du montage expérimental.
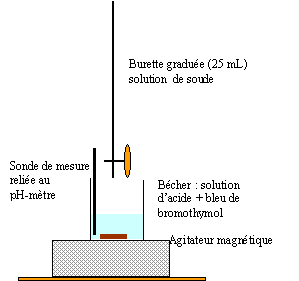
Ll'équivalence
est repérée pour un volume de solution de soude VBéq = 9,3
mL.
2.2. Calculer la
quantité de matière d'ion hydroxyde introduite à l'équivalence.
n = cB VBéq = 1,5 10-2 x9,3 = 0,1395
~0,14 mmol.
2.3. En déduire la
quantité de matière d'aspirine présente dans le volume Va.
n = 0,14 mmol.
2.4. Calculer la
quantité de matière d'aspirine présente dans V = 200 mL de la solution
S.
0,1395 x 20 = 2,79 ~2,8 mmol.
2.5. Calculer la
masse d'aspirine présente dans la solution S. M(aspirine) = 180 g /
mol).
2,79 x 180 = 502,2 ~5,0 102 mg.
2.6.Proposer une
explication de la notation " aspirine 500".
Un cachet contient 500 mg d'asprine.
Exercice 3. la tyrosine.
1.1. Nommer les
deux groupes encadrés.
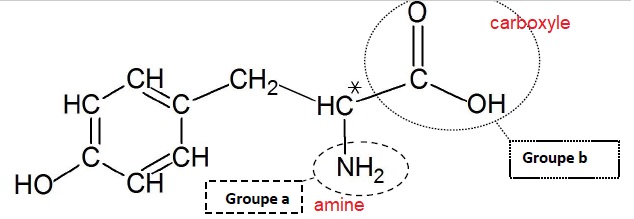
1.2. Expliquer pourquoi la tyrosine
appartient à la famille des acides a aminés.
La tyrosine possède une fonction amine et une fonction acide
carboxylique portées par le même carbone.
1.3. Montrer que le
carbone repéré par * est asymétrique.
Cet atome porte 4 atomes ou groupes d'atomes différents.
1.4. Nommer la
propriété que cet atome de carbone donne à la molécule.
Cette molécule est chirale.
1.5. Déterminer la
formule brute du groupement A. Indiquer s'il s'agit de la molécule
L-tyrosine ou D-tyrosine.
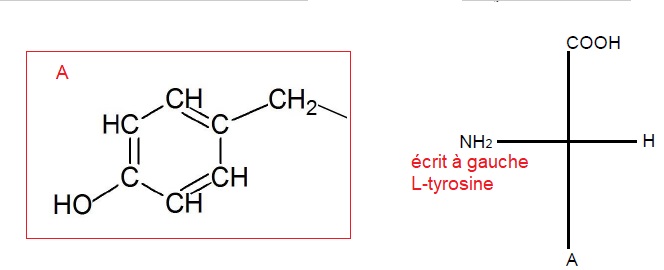
2. Les endorphines sont des
polypeptides.
Dans la première étape de la synthèse d'endorphines, la tyrosine réagit
avec un autre acide a
aminé, la glycine (Gly) pour former le dipeptide Tyr-Gly.
Ecrire la formule semi-développée de la glycine.
Indiquer le nombre de dipeptides que l'on peut obtenir et les nommer.
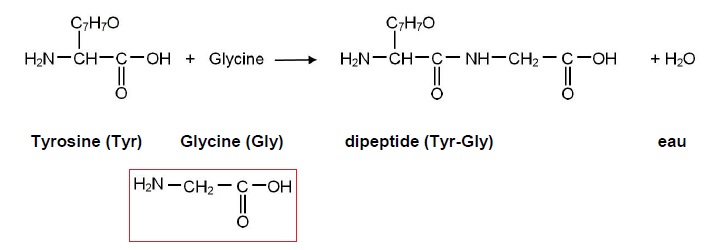
On peut obtenir 4
dipeptides : Gly-Gly ; Tyr-Tyr ; Gly-Tyr ; Tyr-Gly.
|
|