Hémisynthèse
de la vinorelbine, un anticancereux.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Le
taxol est un alcaloïde extrait de l'écorce d'if du Pacifique. Cette
molécule présennte une importante activité anticancereuse. L'extraction
du taxol de l'écorce d'if est impossible sans couper les arbres
et détruire toutes les forêts d'if d'Amérique. Pierre Potier
entreprend des recherches sur une hémisynthèse utilisant des ressources
renouvelables.
1. Expliquer ce
qu'est une hémisynthèse. En quoi se distingue-t-elle d'une synthèse
totale ?
Il s'agit d'une synthèse chimique utilisant un réactif naturel assez
complexe. Ce réactif possède une structure chimique assez proche
du produit désiré.
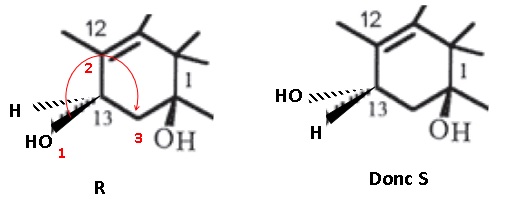
2. Nommer le groupe
caractéristique porté par le carbone n°13 dans la molécule 10-DAB.
Donner, en justifiant, la configuration absolue de cet atome.
C'et le groupe hydroxyle OH, fonction alcool.
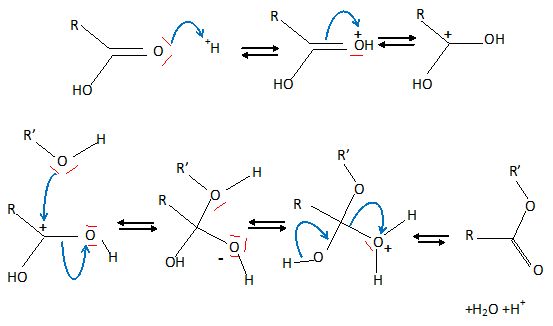
3.
L'hémisynthèse du taxol consiste à greffer la chaîne latérale sur la
10-DAB. Dans un premier temps, la chaîne latérale est produite, puis
est connectée au 10 -DAB. Décrire la réaction permettant la connexion
de la chaîne latérale au 10-DAB en proposant des conditions
expérimentales. Proposer un mécanisme pour cette réaction.
Estérification de la fonction alcool du 10-DAB par un acide
carboxylique ; catalyse acide.
L'une
des découverte majeure de Pierre Potier est l'hémisynthèse de la
vinorelbine à partir d'une molécule présente dans une plante appelée "
pervenche de madagascar". Cette molécule commercialisée sous le nom de
Navelbine constitue l'un des anticancereux les plus vendus dans le
monde.
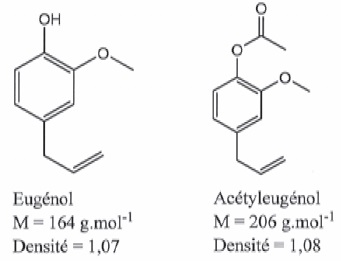
Il existe plusieurs méthodes pour extraire des espèces chimiques de
végétaux. L'une d'entre elles, l'hydrodistillation, est très utilisée
en parfumerie. Cette technique permet entre autres d'obtenir de l'huile
essentielle de clou de girofle, constituée d'eugénol ( majoritaire
) et d'acéthyleugénol.
|
...
|
|
On
considère une situation modèle où l'huile essentielle de clou de
girofle est exclusivement composée d'eugénol. Le diagramme binaire
isobare à pression atmosphérique du système eau-eugénol est donné
ci-dessous. L'axe des abscisses représente la fraction molaire en
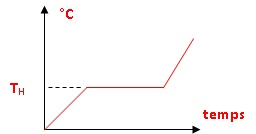
eugénol. La représentation n'est pas à l'échelle. Le point H a pour
coordonnées ( xH = 0,002 ; TH = 96°C). On fournit
également la courbe d'analyse thermique T = f(t) lorsqu'on chauffe,
dans un système fermé, un mélange d'eau et d'eugénol liquide tel que
les quantités de matière apportées d'eau et d'eugénol répondent à la
condition xeugénol < xH.
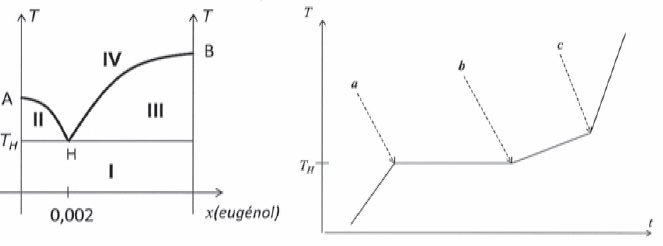
4. Préciser la
nature des phases dans les différents domaines I, II, III et IV.
I : eau liquide et eugénol liquide.
II. eau liquide et vapeurs ( eau + eugénol).
III. eugénol liquide et vapeur ( eau + eugénol).
IV. vapeur ( eau et eugénol).
5. Donner le nom du
point H ainsi que le nom de la courbe en gras.
H correspond au point d'ébullition d'un mélange azéotrope et la courbe
en gras est la courbe de rosée.
6. Décrire les
phénomènes se produisant aux points a, b, c de la courbe T = f(t).
Expliquer à l'aide d'un calcul de variance, l'existence d'un palier de
température entre les points a et b.
a. Le mélange azéotropique eau eugénol entre en ébullition à
température constante jusqu'à vaporisation complète de l'eugénol.
b. L'eau liquide restante entre en ébullition et la température
croït.
c. Fin de l'ébullition de l'eau liquide restante ; la température
croît.
palier entre les points a et b :
Règle des phases : v = c +1 -j.
c = 2 constituants indépendants, eau et eugénol ;
1 : un facteur d'équilibre, la température ; la pression est
maintenue constante.
j = 3
phases ( 2 liquides + vapeur d'eugénol ).
La variance du système est égale à v = 2+1-3 = 0.
7. Que devient la
courbe d'analyse thermique pour un mélange eau-eugénol tel que les
quantités de matière apportées en eau et eugénol répondent à la
condition xeugénol = xH.
Le mélange azéotropique eau eugénol se
comporte comme un corps pur.
|
....
|
On
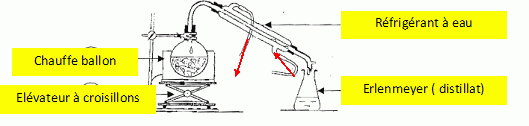
propose en classe de seconde, l'extraction de l'huile essentielle du
clou de girofle par hydrodistillation. les élèves disposent d'un ballon
de 250 mL pour réaliser l'hydrodistillation. Ils obtiennent 50 mL de
distillat.
8. Représenter un
schéma légendé du montage d'hydrodistillation.
9. Un élève se demande quelle est
l'origine de l'aspect laiteux du distillat. Quelle réponse peut-on lui
apporter ?
Il s'agit d'une émulsion, gouttelettes d'eugénol en suspension dans
l'eau.
10. Estimer le
volume d'huile essentielle obtenu avec ce dispositif.
L'eau est le constituant majoritaire du distillat. La masse du
distillat est donc proche de 50 g soit n = 50 / 18 ~2,8 mol.
La vapeur obtenue a la composition de l'azéotrope ( xH =
0,002).
Quantité de matière d'eugénol : 2,8 x0,002 =5,6 10-3 mol.
Masse d'eugénol : 5,6 10-3 x164 ~0,92 g.
Volume d'eugénol : 0,92 / 1,07 ~0,86 mL.
Les spectres IR et RMN de l'eugénol sont donnés ci-dessous.
11. Quelle est
l'ordre de grandeur de la fréquence des ondes électromagnétiques
utilisées en spectroscopie RMN ? De quel type d'onde électromagnétique
s'agit-il ?
C'est une onde radio de fréquence de l'ordre de 400 MHz.
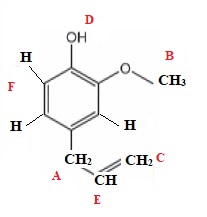
12. Attribuer les
différents signaux du spectre RMN de l'eugénol.
|
A : 3,3 ppm ;
doublet, intégration 2 protons.
B : 3,8 ppm ; singulet ; intégration : 3 protons.
C : 5 ppm, doublet; intégration 2 protons
D :5,7 ppm ; singulet élargi, intégration 1 proton.
E : 5,9 ppm, massif, intégration 1 proton.
F : 6,7 ppm , massif, intégration 3 protons du cycle benzénique.
|
13. Expliquer la
modification observée sur les spectres IR de l'eugénol selon que le
spectre soit réalisé sur le corps pur ou en solution dans le
tétrachlorométhane.
En phase liquide pur, les molécules d'eugénol sont liées par des
liaisons hydrogène : large pic vers 3500 cm-1.
En solution dans CCl4, l'absence de liaisons hydrogène conduit à un pic
plus fin.
|
14. Quelle(s)
utilisation(s) pédagogique(s) de ces deux spectres IR et RMN de
l'eugénol pourrai(en)t être faite(s) en terminale S ?
Problèmatique : la synthèse
de l'acéthyleugénol à partir de l'eugénol est-elle réussie ?
Les élèves
disposent des
spectres IR et RMN de l'eugénol et de l'acéthylleugénol ainsi que des
tables de données IR et des déplacements chimiques en RMN.
Des formules topologiques de l'eugénol et de l'acéthyleugénol.
Les élèves
doivent connaître : le principe des spectroscopie IR et RMN.
Ils doivent être capable d'analyser un spectre RMN.
|
|






