Des
bicarbonates innovants.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Une
solution à base de bicarbonate de sodium et de sels minéraux, agréée
pour une utilisation en agriculture biologique, permet de lutter
efficacement contre certains parasites et d'améloirer l'hygiène
des bâtiments agricoles.
Vous
décidez de vous servir de bicarbonate de sodium NaHCO3 pour illustrer
certaines notions de la partie " réaction chimique par échange de
proton" ou contrôle de la qualité par dosage" du programme en
terminale S.
24.
Expliquer le terme prédominance. Pourquoi cette notion a-t-elle une
importance en chimie des solutions ?:
En solution, l'espèce chimique A prédomine sur l'espèce chimique B, si
la concentration de A est supérieure à celle de B.
On peut ainsi connaître les espèces chimiques majoritaires susceptibles
de réagir.
25.Sur
la fiche technique de cette solution, il est indiqué que le pH de la
solution vaut 8,8. Montrer quantitativement que la présence des
ions carbonate CO32- peut être négligée.
pH = 6,3 + log ( [HCO3- ] / [H2CO3]).
(1).
pH = 10,4 + log ([CO32-] /[HCO3-
]). (2).
Conservation de l'élément carbone : C0 = [H2CO3]
+[CO32-]+[HCO3-
]. (3).
(2) s'écrit : [HCO3-
]=[CO32-]
1010,4 -pH=[CO32-]
101,6~39,8 [CO32-].
(1)
conduit à : [H2CO3]
= [HCO3- ] 106,3
-pH= [CO32-]
1016,7 -2pH=[CO32-]
10-0,9~0,126 [CO32-]
Repport dans (3) : C0
= [CO32-](1+39,8
+0,125) ; [CO32-]
= C0 / 40,9 ~0,024 C0.
On souhaite proposer à des élèves de terminale S spécialité un sujet
blanc d'ECE
26.
Expliquer les résultats suivants. Pour chaque cas, donner l'allure de
la courbe pH = (V) que l'on aurait obtenu si le dosage avait été suivi
par pHmétrie.
Volume d'acide requis pour atteindre le point de fin de titrage
en présence de phénolphtaléine ( zone de virage 8,8 - 10) Vpp
; volume d'acide requis pour atteindre le
point de fin de titrage en présence de vert de bromocrésol ( zone de
virage 3,8 - 5,4) Vvb .
Constituant dans l'échantillon
Na2CO3 : Vvp =2
Vpp.
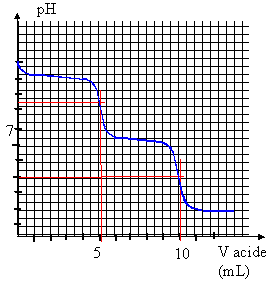
Le premier
saut de pH correspond à : la phénolphtaléine vire du rose à l'incolore
CO3
2- + H3O+ --> H
CO3- + H2O
Le second saut de pH correspond à : le vert
de bromocrésol vire du bleu au jaune.
H CO3- + H3O+
--> CO2 + 2H2O.
Les ions carbonate sont d'abord transformés en hydrogénocarbonate, puis
ceux-ci sont transformés en dihydrogénocarbonate mais en versant deux
fois plus d'acide.
Constituant de l'échantillon
NaHCO3 : Vpp = 0 ; Vvb =>0.
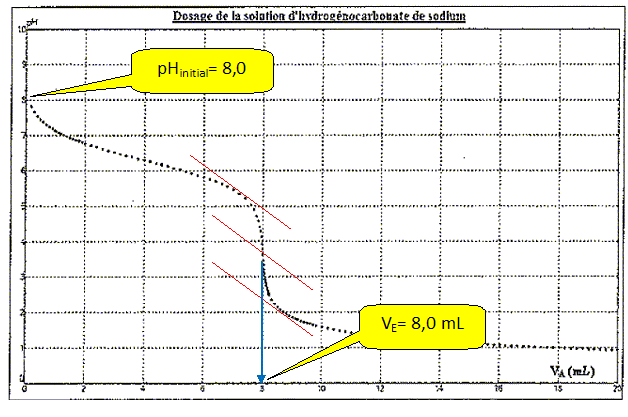
La solution ne contient pas d'ion
carbonate. Le pH initial est voisin de 8 et la phénolphtaléine est
incolore.
Le seul saut de pH correspond à : le vert de
bromocrésol vire du bleu au jaune.
H CO3- + H3O+
--> CO2 + 2H2O.
|
...
|
|
On réalise deux titrages de V= 10,0
mL d'une solution S contenant un mélange de carbonate de sodium Na2CO3
de concentration molaire c1 et d'hydrogénocarbonate de sodium NaHCO3
de concentration c2
par l'acide chlorhydrique à 0,109 mol/ L. le premier titrage est
effectué e présence de phénolphtaléine et le second en présence de vert
de bromocrésol. Les volumes équivalents obtenus sont respectivement Vpp
= 8,2 mL et Vvb = 19,1 mL
27. Déterminer c1 à
l'aide du premier dosage.
n(CO32-) =c1 V= 0,109 Vpp ;
c1 = 0,109 x 8,2 / 10 = 0,089 mol / L
28. Ecrire les
réactions qui se
sont produites lors du virage du vert de bromocrésol dans le second
dosage, puis en déduire une relation entre c1, c2
et Vvb.
CO3 2- + H3O+ --> H CO3-
+ H2O. n(CO32-)
=c1 V.
H
CO3- + H3O+
--> CO2 + 2H2O.
n(HCO3-)
=(c1 +c2)V= 0,109 Vvb.
c1 +c2 = 0,109
Vvb / 10 = 0,109
x19,1 / 10 = 0,208 mol / L ; c2 = 0,12 mol / L.
29. En déduire le
pH de la solution S.
pH = 10,4 + log ([CO32-] /[HCO3-
])= 10,4 + log(0,089 / 0,12) =10,3.
La solution d'acide chlorhydrique est fabriquée à partir d'une solution
commerciale d'acide chlorhydrique à 37 % en masse de densité d =
1,19. La solution obtenue est ensuite étalonnée en réalisant un
titrage d'une masse connue précisément d'hydrogénocarbonate de sodium
par la solution de concentration inconnue d'acide chlorhydrique. Après
avoir réalisé l'étalonnage, une équipe technique transmet les
informations suivantes :
la masse d'hydrogénocarbonate de sodium pesée vaut 140 mg avec une
incertitude-type de 0,3 mg.
Le volume équivalent vaut 15,2 mL avec une incertitude-type de 0,05 mL.
30. Décrire un
protocole permettant d'obtenir 250 mL d'une solution d'acide
chlorhydrique de concentration 0,1 mol / L à partir de la solution
commerciale.
Masse de 1 L de solution commerciale : 1,19 kg.
Masse d'acide chlorhydrique pur dans cette solution :1,19 x0,37 =
0,4403 kg = 440,3 g.
Concentration : 440,3 / M(HCl) = 440,3 / 36,5 ~12,1 mol / L.
Facteur de dilution F = 12,1 / 0,1 = 121.
Volume de solution mère à prélever : 250 / 121 ~2,1 mL.
Protocole :
Port de lunettes de gants et de blouse, la solution commerciale est
corosive.
Dans un becher, prélever 2,1 mL de la solution commerciale à l'aide
d'une pipette graduée de 5 mL + propipette.
Verser le prélevement dans une fiole jaugée de 250 mL contenant un
tiers d'eau distillée.
Compléter la fiole avec de l'eau distillée jusqu'au trait de jauge,
boucher et agiter pour rendre homogène.
31. Donner un
encadrement de la valeur de la concentration molaire de la solution
d'acide chlorhydrique avec un intervalle de confiance de 95 %.
c(HCl) = n(NaHCO3) / Véq avec n(NaHCO3)
=0,140 / 84 =1,67 10-3 mol.
c(HCl) = 1,67 10-3 / 0,0152 ~0,110 mol/ L.
dc(HCl)
= 2 c(HCl) [ ( dm(NaHCO3)
/ m(NaHCO3))2
+ dVéq
/ Véq)2]½ =2 x0,110 [ (0,3 / 140)2
+ (0,05 / 15,2)2]½ ~0,001 mol / L.
Par suite c(HCl) = (0,110 ±0,001) mol / L.
|
....
|
32. Rédiger
une trame de sujet blanc d'ECE sur le thème du dosage des ions
hydrogénocarbonate dans une solution. Pour cela :
- Proposer une problématique.
- Enoncer en une phrase le but de l'épreuve proposée.
- Rédiger un appel permettant d'évaluer chez l'élève les compétences "
s'approprier" et " analyser".
- Rédiger une solution partielle pour cet appel à communiquer au
candidat en cas de difficulté de ce dernier.
Problématique
: vérifier que la concentration en ion hydrogénocarbonate d'une
bouteille d'eau minérale est conforme à celle indiquée sur l'étiquette.
But
: tester les compétences expérimentales des élèves.
Questions, appels
du professeur :
Sur un axe gradué en pH, placer les domaines de prédominances des
espèces H2CO3, HCO3- et CO32-.
(compétence s'approprier ).
Faire de même pour les espèces H3O+, H2O
et HO-.
Pour doser les ions HCO3- de l'eau faut-il
utiliser L'acide chlorhydrique ( acide fort) ou la soude ( base forte
). Justifier. ( compétence analyser ).
Appel au professeur pour vérifier ce choix.
33. Compléter
l'organigramme suivant en faisant apparaître les compétences
expérimentales choisies.
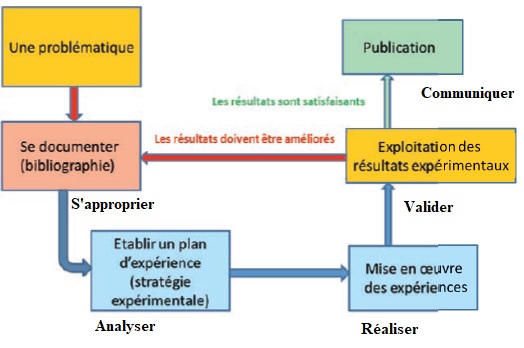
34. Apporter un
regard critique sur la conception de cet organigramme, notamment sur
les différentes étapes guidant la démarche.
La problématique peut être issue de l'exploitation des résultats de
l'expérience.
|
|


