Concours
technicien en chimie et sciences physiques ENS Lyon
2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
Exercice 1 QCM
1. La formule chimique du benzène est :
C12H12 ; C6H12 ; C6H6 ( vrai).
2. Un réactif qui fournit des électrons est :
une base ; un acide ; un réducteur ( vrai) ; un oxydant.
3. La réaction de Friedel et Crafts est une réaction :
d'hydrolyse ; d'addition ; de substitution ( vrai) ; d'élimination.
4. Le principe de la spectroscopie infrarouge repose sur :
les transitions de phases ; les transitions vibrationnelles (vrai) ; les transitions électroniques ; les transitions thermiques.
5. On veut réaliser
une pile cuivre-zinc en utilisant des plaques de cuivre et de zinc et
des solutions de sulfate de cuivre et de zinc de concentration 0,1
mol/L. E°(Cu2+/Cu) = 0,34 V ; E°(Zn2+/Zn) = -0,76 V. Quelle sera la cathode ?
Le cuivre (vrai) ; le zinc ; les données ne permettent pas de le dire.
La cathode est le siège d'une réduction de l'oxydant le plus fort, l'ion cuivre (II).
L'anode est le siège d'une oxydation du réducteur le plus fort, le zinc.
6. Quel est le degré d'oxydation de l'uranium dans le cation uranyle, de formule UO22+ ?
+2 ; +4 ; +6 (vrai) ; +8.
n.o(U) +2(-2) = 2 ; n.o(U) = 2+4 = 6.
Exercice 2. Analyse d'un lait.
Dosage par conductimétrie.
1. On prélève un volume V0 = 20,0 mL de lait ( solution S0) et on les introduit dans une fiole jaugée de volume VS = 100,0 mL.On complète avec de l'eau distillée et on homogénéise pour obtenir la solution S de concentration CS. Quel rapport existe-t-il entre C0 et CS ?
C0 = 100 /20 =5 CS.
2. On verse un volume V1 = 10,0 mL de la solution S dans un becher et on y ajoute environ 250 mL d'eau distillée. Indiquer précisément le protocole à suivre pour prélever 10,0 mL de la solution S.
Verser un peu de solution S dans un bécher, prendre une
pipette jaugée de 10,0 mL ( rincée avec la solution S) surmontée d'un
pipeteur ; utiliser un autre bécher pour placer ce prélevement.
3.
On plonge dans le becher une cellule conductimétrique. Initialement et
après chaque ajout, mL par mL, d'une solution de nitrate d'argent de
concentration C2 = 5,00 10-3 mol/L on détermine la conductivité du milieu réactionnel. Indiqué sur un schéma annoté, le dispositif à mettre en place.
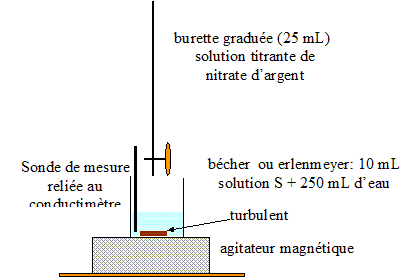
Le suivi conductimétrique du dosage permet d'obtenir la courbe d'évolution de la conductivité s du milieu réactionnel en fonction du volume V2 de nitrate d'argent ajouté.
Equation de réaction de la transformation chimique rapide : Ag+aq +Cl-aq --> AgCl(s).
4. Quelle est l'origine de la conductivité initiale de la solution ?
La conductivité initiale de la solution est due à tous les
ions qu'elle contient et en particulier à l'ion chlorure.
5. En utilisant les valeurs des conductivités molaires
ioniques données ci-dessous, interpréter la variation de la valeur de
la conductivité s du milieu réactionnel au
cours du dosage.
À 25°C : lCl- =
76,3 10-4 m².S.mol-1 ; lNO3- = 71,4 10-4 m².S.mol-1
; lAg+ = 10-4
m².S.mol-1 .
Avant l'équivalence, les ions chlorure sont en
excès, les ions argent ajoutés sont tous consommés ; on ajoute des ions
nitrate d'où l'expression de la conductivité s
du milieu réactionnel : s = lCl- [Cl-] + lNO3- [NO3-].
Du point de vue de la conductivité, tout se passe comme si
on remplaçait les ions chlorure par les ions nitrate ; de plus le
volume de la solution est à peu près constant : or lNO3- < lCl- , en conséquence la
conductivité va diminuer.
Après l'équivalence, les ions chlorure ont disparu,
les ions argent ajoutés ne sont plus consommés ; on ajoute des ions
nitrate d'où l'expression de la conductivité s
du milieu réactionnel : s = lAg+ [Ag+] + lNO3- [NO3-].
Les concentrations de ces deux ions croissent et en conséquence la
conductivité va augmenter.
6. Quel événement correspond au point particulier apparaissant
sur la courbe s = f(V2) ?
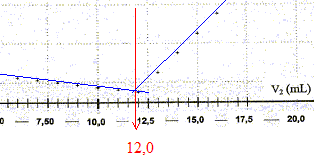
7. Déterminer, en utilisant cette courbe, le volume V2E
de solution de nitrate d'argent versé à l'équivalence.
L'abscisse du point particulier, intersection des deux
segments de droites, apparaissant sur la courbe s
= f(V2) , donne le volume de solution titrante ajouté à
l'équivalence. V2E =12,0 mL
8. Quelle est à l'équivalence la relation entre la quantité de
matière en ions argent introduits et la quantité de matière en ions
chlorure initialement présents ?
9. En déduire la concentration molaire CS en ions
chlorure initialement présents dans la solution S, puis celle C0
dans le lait.
D'après les coefficients stoechiométriques de l'équation de
réaction : Ag+(aq) +Cl-(aq) = AgCl(s), à
l'équivalence la quantité de matière en ions argent introduits est
égale à la quantité de matière en ions chlorure initialement présents.
C2V2E =V1CS d'où
CS =C2V2E /V1
= 5,00 10-3 * 12,0 / 10,0 = 6,00 10-3 mol/L
en tenant compte de la dilution, C0 = 5 CS =3,00 10-2 mol/L.
10. La masse d'ions chlorure présents dans un litre de lait
doit être comprise entre 1,0 g et 2,0 g. Calculer la masse d'ions
chlorure présents dans le lait étudié et conclure. Masse molaire des
ions chlorure : M(Cl-) = 35,5 g.mol-1.
Masse d'ions chlorure présents dans 1 L de lait étudié
: CS *M(Cl-) = 3,00 10-2 *35,5 =1,07 g/L.
La masse d'ions chlorure présents dans un litre de lait
doit être comprise entre 1,0 g et 2,0 g : ce lait correspond
donc à cette norme.
|
|
|
Exercice 3. Identification d'ester.
La formule semi-développée du méthanoate d'éthyle est : HCOO-CH2-CH3.
1. Indiquer la formule semi-développée de l'éthanoate de méthyle.
CH3-COO-CH3.
2.Associer chacun des spectres RMN du proton à l'ester correspondant. Justifier.
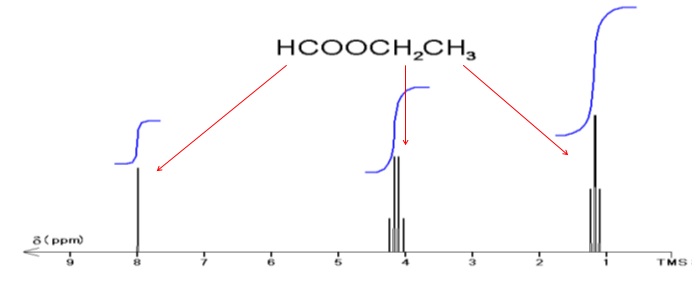
Le spectre RMN de l'éthanoate de méthyle présente deux singulets vers 2 ppm et 3,6 ppm. Le carbone voisin de chaque groupe de protons ne porte aucun hydrogène.
Exercice4. Pourquoi sonder les comètes ?
1.
Donner les noms des groupes caractéristiques communs à toutes les
espèces chimiques dont les formules sont ci-dessous. Justifier le nom "
acide aminé" que l'on donne à ces espèces.
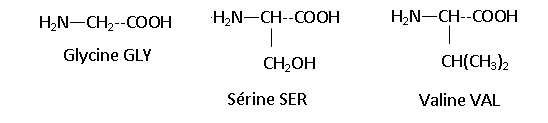
Chaque espèce possède un groupe carbonyle COOH et un groupe amine NH2 portés par le même atome de carbone, d'où le nom acide a aminés.
2. A quel acide aminé correspond le spectre RMN ci-dessous. La spectroscopie IR permettrait-elle de l'dentifier ?
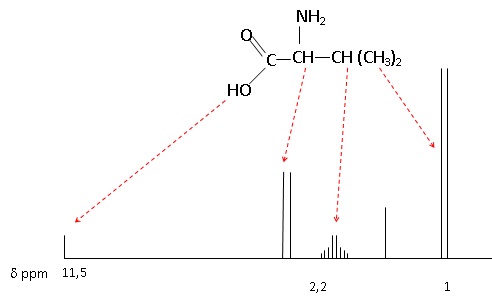
Les acides aminés proposés ayant des structures chimiques voisines, la spectroscopie IR ne permet pas de les identifier.
3. Montrer que la valine possède deux énantiomères que l'on représentera.
La présence d'un atome de carbone asymétrique conduit à l'existence de 2 énantiomères.
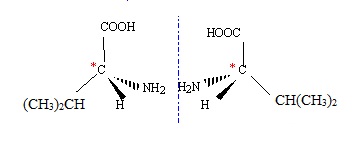
4. Le spectre RMN ci-dessus permet-il de déterminer si un seul ou deux énantiomères sont présents ? Pourquoi ?
La RMN ne permet pas d'identifier l'un ou l'autre énantiomères, ces derniers possèdant les mêmes groupes de protons.
5a. Pourquoi le fait de sonder une comète revient à sonder le système solaire à sa naissance ?
Les comètes sont contemporaines de la formation du système solaire. De
plus passant la plupart de leur temps loin du soleil, là où la
températute est proche de -270°C, elles n'ont pas changé depuis leur
formation.
5b.. Pourquoi le fait que les acides aminés soient présents sur terre avec un énantiomère majoritaire est-il surprenant ?
Première hypothèse
: la vie est apparue à partir d'un mélange contenant 50 % de chaque
énantiomère ( mélange racémique) , l'homochilarité est apparue
progressivement eu cours de l'évolution.
Seconde hypothèse : L'asymétrie conduisant à l'homochilarité est antérieure à l'apparition de la vie et serait d'origine cosmique.
5c. Quelle hypothèse pourrait-on émettre à propos de l'origine des acides aminés présents sur terre ?
Les acides aminés
auraient été synthétisés dans l'espace interstellaire de façon non
racémique et transportés sur terre par des morceaux de comètes ou des
météorites.
|
|
|
|
Gaz parfait.
1. Enoncer l'équation des gaz parfaits et indiquez les unités de chaque granndeur.
PV = nRT.
P : pression en pascal ; V : volume en m3 ; n : quantité de matière ( mol) ; T température en kelvin ; R : constante des gaz parfaits J K-1 mol-1.
2. Compléter le tableau suivant :
Quantité de matière
|
Pression
|
Volume
|
Température
|
2,7 mol H2
|
10 atm
|
10 L
|
445 K
|
42 g N2
|
5 104 Pa
|
0,05 m3
|
-72,5 °C
|
8 10-3 kg CH4
|
454 hPa
|
25 10-3 m3
|
273,15 K
|
1,5 mol diazote
|
0,49 atm
|
51 L
|
200,4 K
|
T = PV / (nR) avec V = 0,01 m3 ; P = 106 Pa.
T = 106 x0,010 /(2,7 x8,314) ~445 K.
n(N2) = PV / (RT avec T = 273-72,5=200,5 K.
n(N2) =5 104 x0,05 /(8,314 x200,5)~1,5 mol
M(diazote) = 28 g /mol ; 28 x1,5 = 42 g.
P = nRT / V avec n = 8 / 16 = 0,5 mol de méthane.
P = 0,5 *8,314 x273,15 / 0,025 =45 419 Pa ou ~454 hPa.
V = nRT / P avec P = 0,49 105 Pa.
V = 1,5 x8,314x200,4 / (4,9 104) =0,051 m3 ou 51 L.
|
|
|





