Chimie,
concours TSPEI 2013 et 2014.
Technicien Supérieur Principal de l'Economie et de l'Industrie
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
Métallurgie du titane.
Le minerai est transformé en dioxyde
de titane TiO2. Cet oxyde réagit à 800 °C sous atmosphère
inerte avec du dichlore en présence de carbone pour donner TiCl4
et du monoxyde de carbone CO.
1. Donner la
structure électronique de l'atome de chlore et le schéma de Lewis de la
molécule de dichlore.
1s2 2s2 2p6 3s2 3p5.
 La droite d'équation y =
0,5 x est asymptote.
La droite d'équation y =
0,5 x est asymptote.
2. Ecrire et
équilibrer l'équation de la réaction.
TiO2 + 2Cl2 (g) +2 C (s) ---> TiCl4
+2CO(g)
3.
Le tétrachlorure de titane est réduit en titane par la magnésium, sous
vide, à 800°C. Ecrire l'équation de la réaction. Montrer que l'élément
magnésium est le réducteur.
TiCl4 +2Mg ---> Ti +2MgCl2.
Le nombre d'oxydation du magnésium passe de zéro dans Mg à +II dans MgCl2.
Le magnésium est un rducteur qui s'oxyde.
4. Une usine
produit 200 tonnes de titane. Déterminer les masses de dioxyde de
titane et de carbone nécessaires.
M(Ti) = 47,9 g /mol ; M(Mg) = 24,3 g/mol.
Quantité de
matière de titane : n = 200 106 / 47,9 = 4,175 106
mol.
Quantité de matière de TiCl4 :
n =4,175 106 mol.
Quantité
de matière de TiO2 : n =4,175
106 mol.
Quantité de matière de carbone
: 2n =8,351 106 mol.
Quantité de matière
de Mg : 2n =8,351 106 mol.
M(TiO2)=47,9+32=79,9
g/mol.
Masse de TiO2 : 79,9 x4,175
106 =3,34 108 g = 334 tonnes.
Masse de carbone : 12 x 8,351
106 =1,00 108 g = 100 tonnes.
Masse de magnésium : 24,3 x
8,351
106 =2,03 108 g = 203 tonnes.
Dureté
d'une eau.
La dureté d'une eau est due à la présence d'ion calcium et magnésium.
Le degré hydrotimétrique est défini par :
°TH = ([Ca2+] +[Mg2+]) / 10-4.
L'eau est dure si °TH > 25.
1. Citer quelques
inconvénients de l'usage d'une eau dure.
Les canalisations s'entatrent ; les savons sont moins efficaces.
2. Ecrire
l'équation de la dissolution du carbonate de calcium CaCO3
dans l'eau. Calculer sa solubilité si Ks = 4,0 10-9
à 25°C
CaCO3(s) = Ca2+aq +CO32-aq.
Ks = [Ca2+aq][CO32-aq] = s2 ; s =(4,0 10-9)½=6,3
10-5 mol/L.
La solubilité du crbonate de calcium vaut 4,1 10-5 mol/L à
85°C. En déduire l'influence de la température sur les dépôts calcaires.
La solubilité diminue quand la température augmente. Il y a davantage
de dépôts calcaire quand la température croît.
3. La
détermination de la
dureté d'une eau s'effectue à pH = 9. L'indicateur coloré est le NET.
En présence d'ion calcium et magnésium, la coloration rouge est due à
la formation d'un complexe. On verse une solution d'EDTA de
concentration c = 0,010 mol/L dans un volume de 100 mL d'eau. Le
changement de couleur se produit pour un volume d'EDTA versé de 22 mL.
La réaction se fait mole à mole.
Faire un schéma du dispositif expérimental. Calculer la dureté de cette
eau. Conclure.
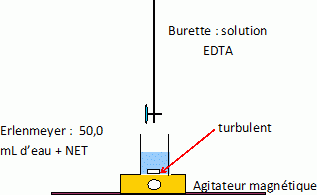
A
l'équivalence, concentration des ion calcium et magnésium : 22 x0,010
/100=2,2 10-3 mol/L.
°TH = 2,2 10-3 / 10-4 = 22. L'eau n'est pas dure.
|
|
|
|
Synthèse
de l'éthanol..
L'éthanol est fabriqué par hydratation de
l'éthylène en phase gazeuse en présence d'un catalyseur.
C2H4 (g)+ H2O (g)= C2H6O
(g), constante d'équilibre K.
1. Ecrire
l'équation en utilisant les formules développées.
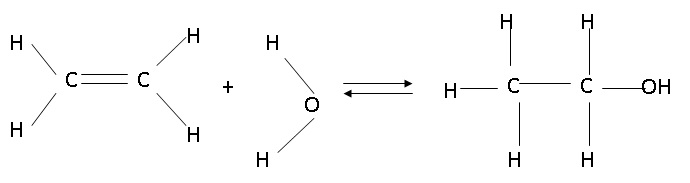
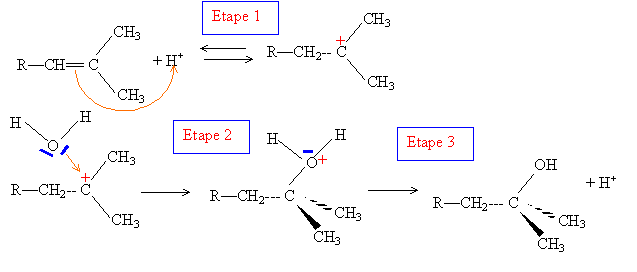
2. Cette réaction
est-elle une réaction d'addition ou de
substitution ? Donner le mécanisme de la réaction.
Addition d'eau sur un alcène.
3. Exprimer la constante K relative
à l'équilibre précédent en fonction des pressions partielles.
K = Palcool / (Palcène Peau).
4. Les réactifs
étant introduits en proportions stoechiométriques, on appelle rendement
noté a le nombre
de moles d'éthanol formé par mole d'éthylène initial. Montrer que K = a(2-a) / (P(1-a).
|
avancement
(mol)
|
éthylène
|
+eau
|
=
éthanol
|
initial
|
0
|
1
|
1
|
0
|
à
l'équilibre
|
a
|
1-a
|
1-a
|
a
|
Nombre total de moles : 2-a.
Pressions partielles : Palcool
= a
P /(2-a) ; Péthylène
= Peau =(1- a) P /(2-a).
Repport dans l'expression de K :
K = a(2-a) / (P(1-a).
5. Quelle est
l'influence sur a
:
d'une élévation de température isobare ? On donne DH°400 = + 42,7
kJ /mol.
DH°400 >0,
réaction endothermique. Une
réaction endothermique est favorisée par une élévation de la
température isobare.
d'une élévation de pression isotherme ?
Le nombre de mole final est inférieur au nombre initial total de
mole : une élévation de pression isotherme déplace l'équilibre dans le
sens direct, formation de l''alcool.
Le
silicium.
Il est obtenu par réduction de la silice SiO2 par le
carbone. On obtient du silicium et du monoxyde de carbone CO.
1. Ecrire
l'équation bilan de la réaction.
SiO2 + 2 C(s) ---> Si(s) + 2CO(g).
2. Montrer que le carbone est le
réducteur.
Le nombre d'oxydation du carbone passe de zéro dans C(s) à +II
dans CO. Le nombre d'oxydation augmente : la carbone est un réducteur
qui s'oxyde.
3. La production
française de silicium a été de 11000 tonnes en 2011.
Calculer les quantités de matière de silicium, de silice, de carbone.
En déduire les masse de carbone et de silice. M(Si) = 28,1 g/mol.
n(Si) = 11 000 106 / 28,1 = 3,91 108 mol.
n(SiO2) = n(Si) ; n(C) = 2 n(Si = 7,83 108 mol.
Masse
de silice = n(silice) M(silice) =3,91 108 x(28,1 +3x12=2)=2,35 1010
g =2,35 104
tonnes.
m(C) = n(C) M(C) =7,83 108x12
=9,4 109 g = 9,4 103
tonnes.
.
|
|
|
|
|
L'eau oxygénée H2O2.
Elle se décompose très lentement en eau et dioxygène. Cette réaction
peut être accélérée en présence de chlorure de fer (III).
1. Donner le nombre
de protons, de neutrons et d'électrons d'un atome d'oxygène.
8 protons, 8 neutrons et
8 électrons.
2.
Donner la configuration électronique d'un atome d'oxygène, d'un atome
d'hydrogène et en déduire le nombre d'électrons de valence.
Oxygène : 1s2 2s2 2p4 ( 6 électrons de
valence).
Hydrogène : 1s1 ( un électron de valence).
3. Donner la
formule de Lewis de la molécule d'eau et sa géométrie d'après la
théorie VSEPR.
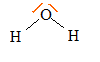 type
AX2E2 donc en forme de V. type
AX2E2 donc en forme de V.
4. Ecrire l'équation bilan de la
réaction de décomposition de l'eau oXygénée.
H2O2 ---> H2O +½ O2.
5. On dispose d'une solution d'eau
oxygénée de volume V = 100 mL de concentration c = 6 10-3
mol. A l'instant initial, on ajoute 20 mL d'une solution de chlorure de
fer (III). On dose ensuite régulièrement la quantité d'eau oxygénée
restante.
t
(min)
|
5
|
10
|
15
|
20
|
quantité
d'eau oxygénée restante (mmol)
|
0,46
|
0,37
|
0,29
|
0,23
|
Calculer la quantité
de matière initiale d'eau oxygénée : V c = 0,100 x6 10-3
= 6,3 10-4 mol = 0,63 mmol.
Calculer les quantités de matière de dioxygène formé à t = 10 min et t
= 15 min.
A t = 10 min : quantité de matière d'eau oxygénée ayant réagi : 0,63
-0,37 =0,26 mmol. Il s'est formé 0,13 mmol de dioxygène.
A t = 15 min : quantité de matière d'eau oxygénée ayant réagi : 0,63
-0,29 =0,34 mmol. Il s'est formé 0,17 mmol de dioxygène.
Calculer la vitesse moyenne ( mol s-1) de formation du
dioxygène entre ces deux instants.
(0,17-0,13) / (5 x60)= 1,33 10-4 mmol s-1 = 1,33
10-7 mol s-1.
Comment appelle t-on le rôle joué par la solution de chlorure de fer
(III).
Catalyseur.
Protection du fer.
Pour protéger contre la corrosion une cuve en acier ( fer + carbone)
enfouie dans le sol, on la relie par l'intermédiaire d'un fil métalique
à une électrode de magnésium.
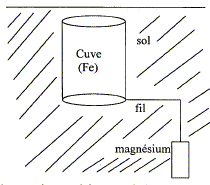
Données : potentiel standard des couples redox
E°(Fe2+ / Fe) = -0,44 V ; E°(Mg2+ / Mg) = -2,37 V
Masse molaire ( g/mol) Fe : 55,8 ; Mg : 24,3 ; 1 F = 9,65 104
C.
1. Ecrire et
équilibrer les demi-équations électroniques qui se produisent sur
l'électrode de magnésium et sur la cuve.
Indiquer l'oxydation et la réduction.
Oxydation du magnésium : Mg = Mg2+ + 2e-.
Réduction des ions Fe2+ ( au niveau de la cuve) : Fe2++
2e- = Fe.
2. Compléter
le schéma en indiquant le sens de circulation des électrons, le sens de
l'intensité du courant, le pôle +, le pôle-, l'anode, la cathode.
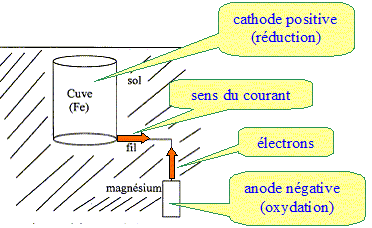
3. Expliquer
pourquoi le magnésium est capable de protéger le fer.
Le magnésium est un métal plus
réducteur que le fer : E°(Mg2+
/ Mg) <E°(Fe2+
/ Fe)
Le magnésium s'oxyde à la place du fer ; ce dernier est donc protégé
tant qu'il y a du magnésium.
La masse de magnésium utilisé est m = 200
g. On admet que le courant de protection d'intensité I=15 mA est
constant.
4. Calculer la
durée Dt de cette protection, exprimée en
secondes puis en années.
Quantité de matière (mol) de magnésium = masse (g) / masse molaire
(g/mol)
n(Mg) = m/M= 200 / 24,3 = 8,23 mol
Or Mg = Mg2+ + 2e-.
donc la quantité de matière d'électrons est égale à : n(e-)
= 2 n(Mg) = 16,5 mol ( 16,460)
La quantité d'électricité traznsportée par une mole d'électrons est :
96500 C
Quantité d'électricité Q = 96500 * n(e-) = 96500*16,46 =
1,59 106 C ( 1,5885 106)
Quantité d'électricité Q = IDt avec I=
0,015 A
Dt = 1,5885 106 / 15
= 1,06 108 s soit 3,36 ans.
5. Quelle serait la masse de fer
qui disparaîtrait pendant la même durée, dans les mêmes conditions si
la cuve n'était pas protégée ?
n(Fe) = n(Mg) = 8,23 mol
masse (g) = masse molaire du fer
(g/mol) * quantité de matière (mol)
m(fer) = 55,8*8,23 = 459 g.
|
|
|