Chimie,
Concours TSPEI 2017.
Technicien supérieur principal de l'économie et de l'industrie.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
Cinétique de décomposition d'un élément radioactif.
L'américium
241 fait partie des déchets générés par une centrale nucléaire.
L'évolution du nombre de noyaux d'une substance radioactive suit une
loi cinétique d'ordre 1 : dN / dt = -lN où l est la constante radioactive.
1. Exprimer N(t) nombre de noyaux à la date t en fonction de N0, nombre initial de noyaux, l et t.
N(t) = N0 exp(-lt).
2. Le temps de demi-vie t½ est la durée au bout de laquelle la moitié des noyaux d'un échantillon s'est désintégré. En déduire une relation entre l et t½.
N(t½) = 0,5 N0 = N0exp(-lt½) ; 0,5 = exp(-lt½) ; lt½ = ln 2..
3.
Le graphe ci-dessous représente le nombre de noyaux d'un échantillon de
masse m = 1,00 g d'américium 241. Déterminer graphiquement t½; en déduire l en an-1 et en s-1.
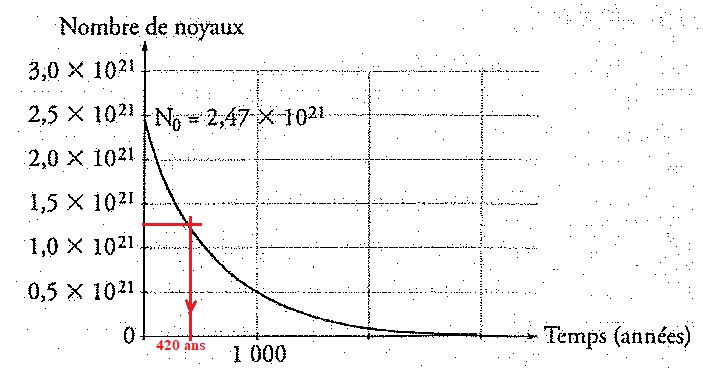
t½ = 420 ans = 420 x365 x24 x3600 =1,32 1010 s ; l = ln2 / 420 = 1,65 10-3 an-1 ou ln2 / (1,32 1010) =5,25 10-11 s-1.
4. L'activité ( Bq) d'un échantillon est relié au nombre de noyaux par la relation A = l
N. Un élément radioactif peut ^tre considéré comme un déchet de faible
activité si l'activité d'un échantillon d'un gramme est inférieure à
3,7 103 Bq.
Déterminer la date au bout de laquelle l'américium 241 pourra être considéré comme un déchet de faible activité.
A0 =2,47 1021 x 5,25 10-11 =1,297 1011 Bq.
ln(A / A0 )= -l t ; ln(3,7 103 / (1,297 1011) = -17,37 ; t = 17,37 / (1,65 10-3) =1,05 104 ans.
Titrage acido-basique.
On veut déterminer le pourcentage massique d'hydrogénosulfate de sodium contenu dans une poudre. Les propriétés acido-basiques de cette poudre sont dues uniquement à la présence de l'ion hydrogénosulfate HSO4- appartenant au couple HSO4- / SO42- dont le pKa vaut 1,9 à 25°C.
A. Titrage direct.
On dissout m = 1,00 g de cette poudre dans de l'eau distillée jusqu'à obtention d'une solution S limpide de volume V = 100,0 mL.
1. Précisez le matériel utilisé pour cette préparation.
Balance de précision ( au centième), coupelle, spatule.
Eau distillée, fiole jaugée de 100,0 mL.
Mchaux = 40 +16 = 56 g/mol.
2. On prélève VA = 20,0 mL de S que l'on dose par une solution d'hydroxyde de sodium de concentration Cb = 0,100 mol/Len utilisant un pHmètre. Le volume équivalent est VBE = 14,8 mL
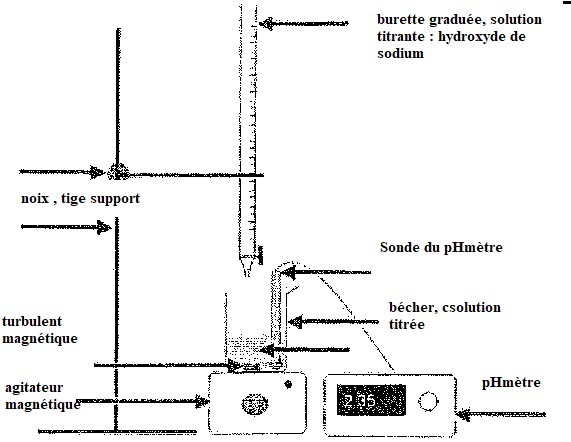
a. Annoter le schéma du dispositif de titrage.
b. Ecriire l'équation bilan de la réaction de dosage.
HSO4-aq + HO-aq ---> SO42-aq + H2O (l).
c. Déterminer l'expressio de la constante de réaction du dosage puis la calculer et conclure.
K = [SO42-aq] / ([HSO4-aq ] [HO-aq])=[SO42-aq] [H3O+aq]/ ([HSO4-aq ] [HO-aq][H3O+aq])=Ka / Ke = 10-1,9 / 10-14 =1,26 1012.
K étant très grande, la réaction de dosage est totale.
d. Déterminer la concentration CA de la solution S en hydrogénosulfate.
A l'équivalence : CAVA = CbVBE ; CA =0,100 x 14,8 / 20,0 = 7,40 10-2 mol / L.
e. En déduire le pourcentage massique d'hydrogénocarbonate de sodium contenu dans cette poudre.
M(HSO4Na) = 1 +32,1 +4 x16 +23) = 120,1 g/mol.
Dans 20,0 mL il y a 0,074 x 0,020 =1,48 10-3 mol.
Soit 1,48 10-3 x5 = 0,0074 mol dans 100 mL.
0,0074 x120,1 =0,88874 g dans 1,00 g de poudre.
0,88874 / 1,00 x100 ~88,9 %.
|
|
|
B. Titrage en retour.
On place m = 1,00 g de cette poudre dans un erlenmeyer. On ajoute V0 = 20,0 mL de soude de concentration C0
= 1,00 mol/L ; la quantité de base est en excès par rapport à celle des
ions hydrogénosulfate. On dose l'excès de soude par une solution
d'acide chlorhydrique de concentration C1 = 1,00 mol/L.
Le virage de l'indicateur coloré se produit pour un volume VAE = 12,2 mL de cet acide.
1. Ecrire l'équation chimique relative à cette réaction.
H3O+aq + HO-aq --- 2H2O(l).
2. Déterminer la quantité de matière n0 d'ion hydroxyde versé dans l'erlenmeyer.
n0 = V0C0 = 0,0200 x1,00 = 0,0200 mol.
3. Déterminer la quantité de matière n1 d'ion hydroxyde restant dans l'erlenmeyer et en déduire la quantité n2
d'ion hydroxyde ayant réagi avvec 1,00 g de poudre. En déduire la
quantité de matière n d'hydrogénosulfate de sodium contenu dans 1,00 g
de cette poudre.
n1 = C1 VAE =1,00 x 12,2 10-3 = 1,22 10-2 mol.
n =n2 = n0 -n1 = (2,00 -1,22) 10-2 = 7,80 10-3 mol.
4. En déduire le pourcentage massique d'hydrogénosulfate de sodium dans cette poudre. Les résultats sont-ils en accord ?
7,80 10-3 x120,1 = 0,9368 g d'hydrogénosulfate de sodium dans 1,00 g de poudre.
Pourcentage massique correspondant : 0,9368 / 1 x100 ~93,7 %.
Ecart relatif : ( 93,7-88,9) / 90 x100 ~5,3 %.
A 5,3 % près, les résultats sont en accord.
Préparation du bore.
La préparation du bore s'effectue à 1000 °C selon la réaction :
3 Mg(l) +B2O3(l) = 3MgO(s) + 2B(s).
1. Calculer la masse m(Mg) de magnésium nécessaire pour produite m(B) = 1,00 tonne de bore.
n(B) = m(B) / M(B) = 1,0 106 / 10,81 ~9,25 104 mol.
n(Mg) = 1,5 x9,25 104 = 1,3876 105 mol.
m(Mg) = n(Mg) x M(Mg) = 1,3876 105 x24,3 =3,37 106 g ~ 3,4 tonnes.
2. Calculer l'enthalpie standard de réaction à 25°C et conclure.
DrH° =2 DfH°(B(s)) +3 DfH°(MgO(s)) -DfH°(B2O3(l))-3DfH°(Mg(l)).
DrH° =2x0 +3x(-602)-(-1251)-3 x9= -582 KJ / mol.
DrH° est positif, la réaction est exothermique.
3. Calculer l'entropie standard de la réaction à 25 °C et comclure.
DrS° =2 S°(B(s)) +3 S°(MgO(s)) -S°(B2O3(l))-3S°(Mg(l)).
DrS° =2x5,9 +3x27-84-3 x42=11,8 +81-84- 126= -117,2 J K-1 mol-1
L'entropie est négative, les réactifs étant liquides et les produits étant solides, le désorde diminue.
4. Du point de vue thermodynamique, faut-il réaliser cette synthèse à haute température ? Justifier.
La réaction étant exothermique, elle est défavorisée par une température élévée.
5. Du point de vue thermodynamique, faut-il réaliser cette synthèse à haute ou à basse pression ? Justifier.
Ni les réactifs, ni les produits ne sont gazeux : la pression ne joue aucun rôle.
6. Calculer l'enthalpie libre standard à 1000°C.
DG° =DrH° -TDrS° = -5,82 105 -1273 x (-117,2) = - 4,32 105 J / mol.
6. Calculer la constante thermodynamique K de la réaction à 1000 °C.
DG° = -RT ln K ; ln K = 4,32 105 /(8,314 x1273)=40,89 ; K ~5,8 1017.
|
|
|
|
Parfums et arômes.
1. On considère deux alcools A ( 2-méthylbutan-1-ol) et B ( 3-méthylbutan-1-ol). Ecriire leur formule semi-développée.
Préciser le type d'isomérie. Qu'appelle t-on molécule chirale ?
Quelle est, de A ou de B, la molécule chirale ? Justifier.
Donner une représentation spatiale de chaque énantiomère. Préciser la configuration absolue ( R ou S)
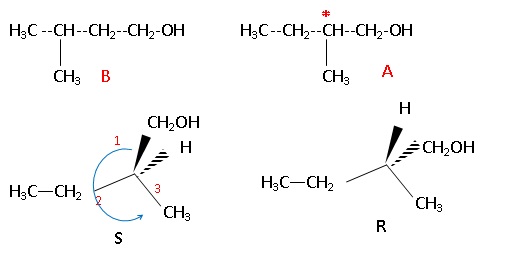
A et B sont isomères de chaîne. A est chirale, présence d'un atome de carbone asymétrique.
2. L'alcool B peut réagir avec l'acide éthanoïque pour donner l'éthanoate de 3-méthylbutyle ( E).
CH3-COOH + C5H12O = C7H14O + H2O.
Ecrire la formule semi-développée de E.
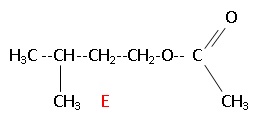
3. Pour
synthétiser E, on réalise un chauffage à reflux. On fait réagir pendant
une heure m(C) = 53,0 g d'acide éthanoïque C avec m(B) = 33,0 g de B en
présence d'acide sulfurique. et de quelques grains de pierre ponce.
Annoter le montage de chauffage à reflux.
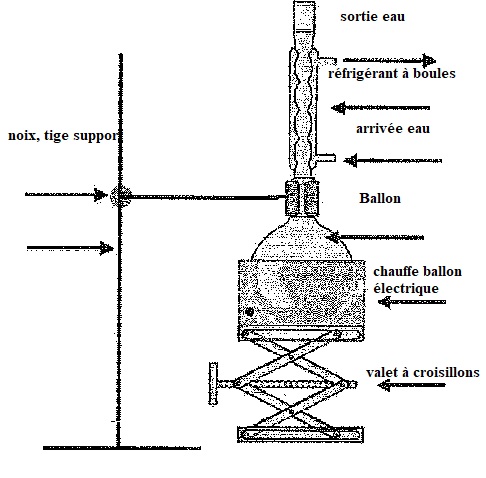
4. Quel est le rôle de l'acide sulfurique ? De la pierre ponce ?
L'acide sulfutique est un catalyseur ; la pierre ponce régularise l'ébullition.
5. L'extraction de l'ester comporte trois étapes :
Séparation
: on verse le contenu du ballon dans une ampoule à décanter de 250 mL
contenant 100 mL d'eau froide. Après avvoir agité et laissé décanter,
la phase aqueuse est éliminée.
Lavage de la phase organique : on ajoute dans l'ampoule 30 mL de solution d'hydrogénocarbonate de sodium à 10 % en masse. On observe un dégagement gazeux.
- Séchage : on
recueille la phase organique dans un becher et on ajoute 1 g de sulfate
de magnésium anhydre. On filtre pour éliminer la phase solide.
Représenter l'ampoule à décanter en indiquant la position des phases et leur contenu.
La phase aqueuse contient l'acide éthanoïque qui n'a pas réagi, l'acide
sulfurique et l'eau. La densité de cette phase est voisine de 1.
La phase organique contient l'alcool qui n' a pas réagi et l'ester. La densité de cette phase est voisine de 0,84.
La phase la plus dense ( phase aqueuse) occupe la partie inférieure de
l'ampoule. La phase organique occupe la partie supérieure.
6. Le dégagement produit lors du lavage résulte de la réaction entre l'acide éthanoïque et l'ion HCO3-. Ecrire l'équation de la réaction et identifier le gaz.
CH3-COOH + HCO3----> CH3COO- + H2O + CO2. ( dioxyde de carbone ).
7. Quel est le rôle du sulfate de magnésium anhydre ?
Désydratant.
8. On recueille V(E) = 37,0 mL de E ( densité d = 0,87 ).
Définir puis calculer le rendement de la réaction.
Indiquer une méthode pour augmenter ce rendement.
Mase d'ester : m = 37,0 x 0,87 = 32,19 g.
Quantité de matière d'ester : m / M(E) = 32,19 / 130 ~0,2476 mol.
Quantité de matière initiale d'alcool : m(B) / M(B) = 33,0 / 88 ~0,375 mol.
Quantité de matière initiale d'acide éthanoïque C : m(C) / M(C) = 53,0 / 60 ~0,883 mol. ( en excès par rapport à l'alcool).
Quantité de matière théorique d'ester ( si réaction totale) : 0,375 mol.
Rendement = quantité de matière expérimentale / quantité de matière théorique = 0,2476 / 0,375 = 0,66 ( 66 %).
On peut augmenter le rendement en éliminant le produit le plus volatil
au fur et à mesure qu'il se forme ou encore en ajoutant un excès
d'acide éthanoïque.
|
|
|