La
cerise,
bac S Antilles 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
Partie A : Vitamine B5.
La cerise est connue pour ses nombreux apports nutritionnels. On peut
notamment remarquer ces apports en vitamine et particulièrement la
vitamine B5. Cette vitamine n’est autre que l’acide pantothénique dont
une représentation est donnée ci-dessous.
1. Écrire la formule semi-développée de cette molécule, puis entourer
les différents groupes caractéristiques présents et nommer les familles
des fonctions correspondantes.
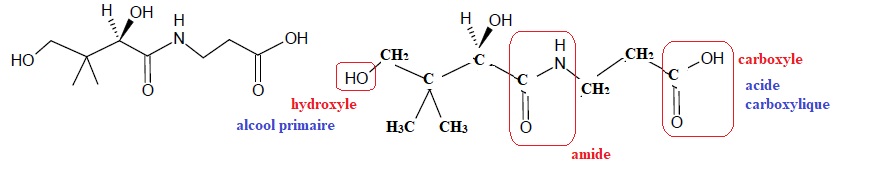
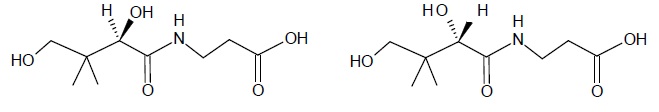
2. Déterminer si la
molécule de vitamine B5 est chirale. Possède-t-elle des stéréoisomères
de configuration ? Si oui, les dessiner en utilisant la représentation
de Cram et indiquer la relation d’isomérie entre ces stéréoisomères.
La molécule possède un atome de carbone asymétrique ; elle est chirale ; il existe deux énantiomères.
Partie B : Synthèse de l’arôme de cerise.
La synthèse de l’arôme de cerise peut être réalisée au laboratoire par
la mise en oeuvre d’une réaction d’estérification. L’un des premiers à
avoir étudié ce type de réaction est le chimiste français Marcelin
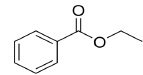
Berthelot. L’arôme de cerise est composé d’un ester dont le nom en
nomenclature officielle est le benzoate d’éthyle et dont une
représentation est donnée ci-dessous.
Au laboratoire, le benzoate d’éthyle est préparé à partir de l’acide
benzoïque et de l’éthanol selon la réaction d’estérification d’équation
:
Acide benzoïque + éthanol ⇆ benzoate d’éthyle + X
Le protocole mis en oeuvre est le suivant :
a) Dans un ballon de 100 mL, introduire 2,00 g d'acide benzoïque et,
tout en agitant, ajouter goutte à goutte 20 mL d'éthanol puis 1 mL
d’acide sulfurique concentré ;
b) Chauffer à reflux pendant 2 h ;
c) Évaporer l’alcool restant par distillation fractionnée ;
d) Transvaser le liquide restant dans une ampoule à décanter contenant une solution aqueuse salée saturée ;
e) Laver la phase organique avec 10 mL d'une solution aqueuse à 10 % d'hydrogénocarbonate de sodium ;
f) Séparer la phase aqueuse de la phase organique, et transvaser la phase organique dans un erlenmeyer propre et sec ;
g) Ajouter à la phase organique environ 1 g de sulfate de magnésium anhydre.
La masse d’ester obtenue est m = 1,48 g.
1. Réaction de synthèse du benzoate d’éthyle et mécanisme réactionnel
1.1. Justifier le nom donné, en nomenclature officielle, à la molécule responsable de l’arôme de cerise.
Ester de l'éthanol et de l'acide benzoïque : benzoate d'éthyle.
1.2. Représenter la formule semi-développée de l’éthanol.
CH3-CH2-OH.
1.3. Écrire la formule de la molécule X produite lors de la réaction d’estérification. Justifier.
La réaction entre un acide carboxylique et un alcool donne un ester et H2O, eau.
1.4. Le mécanisme réactionnel de l’estérification est proposé.
Indiquer les sites accepteurs et donneurs de doublets d’électrons mis en jeu dans l’étape 1.
1.5. Utiliser le modèle de la flèche courbe, pour rendre compte de l’étape 1 et représenter ces flèches .
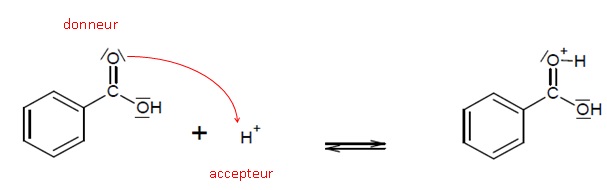
1.6. Identifier les étapes du mécanisme réactionnel correspondant à des réactions d’addition et d’élimination.
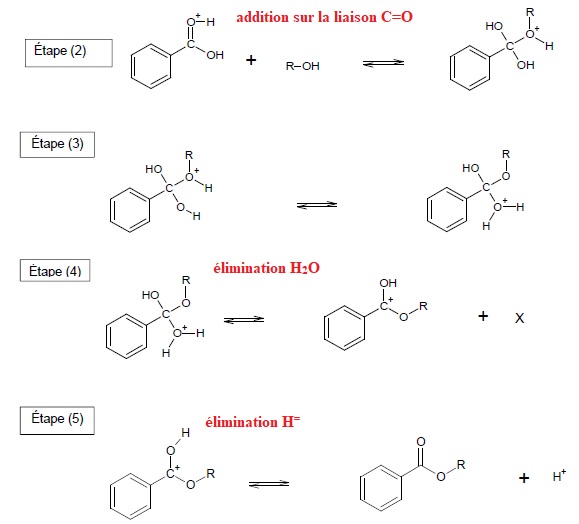
1.7. Quel rôle joue l’ion H+ dans cette réaction ? Justifier.
C'est un catalyseur. Il participe à la réaction ( étape 1) . il est régénéré lors de la dernière étape.
|
|
2. Mise en oeuvre du protocole de synthèse et identification du produit formé
2.1. Parmi les
montages ci-dessous, choisir celui qui permet de réaliser la synthèse
du benzoate d’éthyle (étape a et b). Expliquer son fonctionnement et
son intérêt.
La température est un facteur cinétique. Ce montage évite les pertes de
matière : les vapeurs se condensent dans le réfrigérant et retombent
dans le milieu réactionnel.
Montage B : chauffage à reflux..
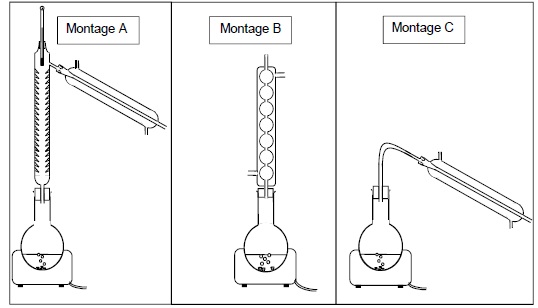
2.2. Parmi les montages ci-dessous, choisir celui qui permet d’éliminer l’éthanol restant (étape c).
Expliquer pourquoi l’élimination de l’éthanol est possible par cette méthode.
Montage A, distillation fractionnée.
L'éthanol est le constituant le plus volatil.
|
|
|
|
2.3. Indiquer les précautions à prendre lors de la manipulation de l’acide sulfurique concentré.
L'acide sulfurique concentré est corrosif : port de blouse, gants et lunettes de protection.
Afin de caractériser l’ester formé lors de la synthèse, on réalise son
spectre RMN. Les résultats obtenus sont détaillés dans le tableau
ci-dessous :
déplacement chimique ( ppm)
|
8,1 à 7,4
|
4,4
|
1,4
|
nombre de protons du signal
|
5
|
2
|
3
|
multiplicité
|
multiplet
|
quadruplet
|
triplet
|
2.4. Montrer que les données du spectre RMN sont compatibles avec le produit formé dans la synthèse.
Le multiplet correspond aux 5 protons du noyau benzénique.
Le quadruplet correspond aux protons du groupe CH2 couplés avec les protons du groupe méthyle CH3.
Le triplet correspond aux protons du groupe CH3 couplés avec les protons du groupe CH2.
2.5. Quelle autre méthode aurait-on pu utiliser pour réaliser l’identification du produit formé ? Justifier.
Spectroscopie IR.
Bande forte et fine vers 1720 cm-1 ( C=O).
3 à 4 bandes vers 1500 cm-1 ( C=C aromatiques).
2.6. Déterminer la valeur du rendement de la synthèse réalisée au laboratoire.
Quantité de matière des réactifs : n(acide benzoïque ) = 2,00 / 122 = 0,0164 mol.
n(éthanol) = 20 x0,79 / 46,1 = 0,343 mol ( en excès).
Quantité de matière maximale d'ester : 0,0164 mol soit 0,0164 x150,2 = 2,46 g.
Rendement : 1,48 / 2,46 ~0,60 ( 60 %).
2.7. Proposer une ou plusieurs hypothèses pour justifier que ce rendement est inférieur à 100 %.
La réaction d'estérification est limitée par l'hydrolyse de l'ester.
|
|
|