Autour
du nitrate d'ammonium, bac S Nlle Calédonie 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
| .
. |
......
.....
|
Le nitrate d'ammonium est un solide ionique de formule NH4NO3.
M(HNO3) = 63,0 g / mol ; M(NH4NO3) = 80,0 g / mol.
pKa du couple NH4+ / NH3 : 9,2 à 25°C.
Conductivité molaire ionique à 25°C. (mS m2 mol-1)
l(NH4+)=7,35 ; l(Cl-)=7,63 ; l(H3O+)=34,98.
1. Préparation d'une solution d'acide nitrique de concentration 1,0 mol / L.
L'étiquette de la solution concentrée indique : pourcentage massique d'acide nitrique 58 %.
Afin de déterminer la masse volumique de cette solution, on mesure la
masse de 25,0 mL d solution contenue dans une fiole jaugée et on
obtient 33,76 g.
1.1 Déterminer la masse volumique de cette solution notée S1.
r1 = m / V = 33,76 / 25,0 = 1,35 g / mL.
1.2 Déterminer le volume de 100 g de cette solution.
100 / 1,35 ~74,1 mL.
1.3 En déduire que la concentration de l'acide nitrique dans la solution S1 est environ 12 mol / L.
Il y a 58 g d'acide nitrique dans 100 g de solution soit :
58 / 63,0 = 0,9206 mol dans 74,1 mL ( 0,0741 L).
Concentration : 0,9206 / 0,0741 = 12,4 ~12 mol / L.
1.4. On dilue la solution S1. On désire obtenir 200,0 mL de solution S2 d'acide nitrique de concentration 1,0 mol/ L.
Déterminer le volume V1 de solution S1 à prélever.
Facteur de dilution F = 12,4 / 1,0 = 12,4.
V1 = 200 / 12,4 ~16 mL.
1.5. Dans la liste suivante, choisir les éléments de verrerie appropriés pour réaliser cette dilution :
pipette jaugée de 20,0 mL , pipette graduée de 20 mL, éprouvette
graduée de 200 mL, éprouvette graduée de 20 mL, fiole jaugée de 200,0
mL, fiole jaugée de 20,0 mL.
Fiole jaugée de 200,0 mL et pipette graduée de 20 mL.
1.6 La solution S2 est diluée d'un facteur 100 et la valeur du pH de la solution fille S3 mesuré est 2,0. L'acide nitrique est-il un acide faible ou un acide fort ?
C3 = 0,010 mol / L ; pH = - log C4.
L'acide nitrique est un acide fort.
2. Titrage de la solution d'ammoniac.
On souhaite vérifier la concentration molaire d'une solution S4 d'ammoniac NH3. On réalise un titrage avec une solution d'acide chlorhydrique (H3O+aq + Cl-aq) de concentration 1,0 mol/L.
Une prise d'essai de volume V = 20,0 mL de la solution S4 est versée dans un becher de 500 mL et compléter d'environ 400 mL d'eau distillée. le titrage est suivi par conductimétrie.
2.1 Ecrire l'équation de la réaction support du titrage.
NH3aq + H3O+aq ---> NH4+aq + H2O(l).
2.2. Justifier le changement de pente observé.
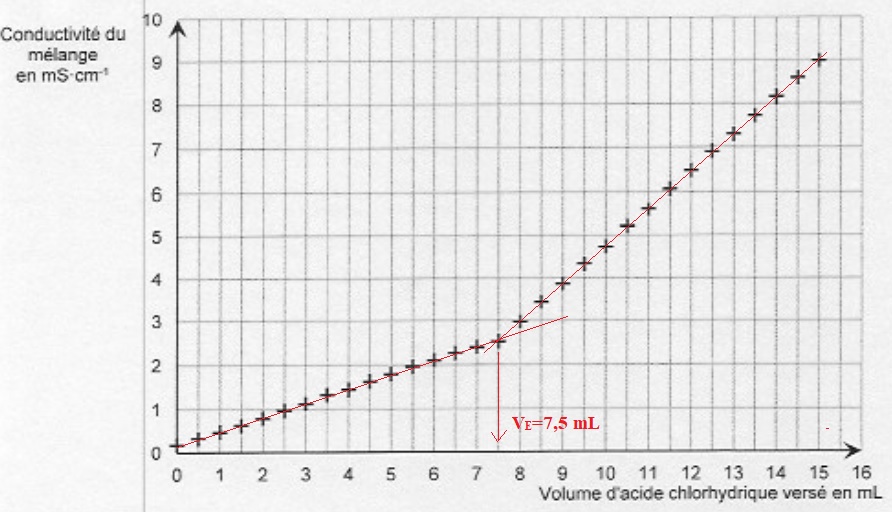
Avant l'équivalence, H3O+aq est en défaut ; on ajoute des ions Cl- et il se forme des ions NH4+aq. la conductivité de la solution augmente.
Après l'équivalence H3O+aq est en excès et on ajoute des ions Cl- ; la conductivité molaire ionique de l'ion H3O+aq étant bien supérieure à celle de l'ion ammonium, la conductivité de la solution croît plus rapidement.
2.3. Montrer que la concentration de la solution S4 est 0,38 mol / L.
A l'équivalence : quantité de matière d'ion H3O+aq = 1,0 x7,5 = 7,5 mmol.
Quantité de matière d'ammoniac : 7,5 mmol dans 20,0 mL soit 7,5 / 20 = 0,375 ~0,38 mol / L.
|
|
.
|
....
|
3. Synthèse du nitrate d'ammonium.
Dans un becher de 200 mL on mélange 25,0 mL de la solution S2 d'acide nitrique et 25,0 mL de solution S4 d'ammoniac. On obtient 0,88 g de nitrate d'ammonium.
NH3 aq + H3O+aq +NO3-aq ---> NH4NO3(s) + H2O(l).
3.1. Calculer le rendement de la synthèse sachant que la réaction est totale.
Quantité de matière d'acide nitrique : 0,025 x1,0 =0,025 mol.
Quantité de matière d'ammoniac : 0,025 x0,38 =0,0095 mol ( en défaut).
On peut espérer obtenir au mieux 0,0095 mol de nitrate d'ammonium soit 0,0095 x 80,0 =0,76 g.
Le rendement est 0,88 / 0,76) supérieur à 1: le nitrate d'ammonium n'est pas pur.
3.2. Proposer une
raison possible sur l'état du ssolide obtenu en fin de réaction ce qui
expliquerait que la masse de nitrate d'ammonium mesurée est trop
élevée. En déduire une solution pour y remédier.
Le nitrate d'ammonium est hygroscopique, il fixe de l'eau.
Chauffer le solide dans une étuve pour éliminer l'eau.
|
|
