L'isoprène,
bac S Polynésie 2019
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
L’isoprène
a été découvert en 1860 et isolé à partir de la décomposition thermique
du caoutchouc naturel. Il est produit et émis dans l’atmosphère par
beaucoup d’espèces d’arbres (par exemple chênes, peupliers,
eucalyptus). Cette production d’isoprène semblerait être un des
mécanismes développés par les forêts pour surmonter la surchauffe des
feuilles ou une irradiation excessive par le rayonnement ultra-violet.
D’après le site www.societechimiquedefrance.fr/isoprene.html
Données :
· Masse volumique de la propanone : r = 790 kg.m-3.
1. L’isoprène.
L’isoprène est un hydrocarbure également appelé 2-méthylbuta-1,3-diène, dont une représentation est donnée ci-dessous.
1.1. Justifier le nom attribué à l’isoprène en nomenclature officielle et donner sa formule semi-développée.
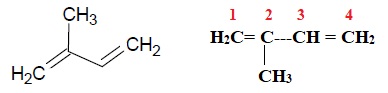
La plus longue chaine compte 4 atomes de carbone d'où but.
Présence de deux doubles liaisons entre les atomes de carbone 1- 2 et 3-4 d'où 1,3-diène.
Un groupe méthyle porté par le cabone n° 2.
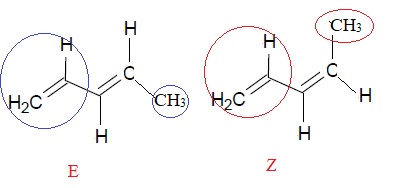
1.2. L’un des isomères de l’isoprène, le penta-1,3-diène, a pour formule semi développée :
CH2 = CH – CH = CH(CH3)
Représenter, en les identifiant, les formules topologiques des deux stéréoisomères Z et E possibles du penta-1,3-diène.
1.3. Par hydrogénation catalytique de l’isoprène, on obtient le 2-méthylbutane.
1.3.1. Écrire la formule semi-développée du 2-méthylbutane.
1.3.2. Indiquer, en le justifiant, le nombre de signaux attendus sur le spectre
de RMN du proton du 2-méthylbutane, ainsi que la multiplicité de chaque signal.
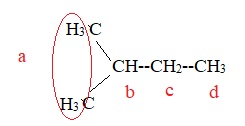
Protons a : doublet ; l'atome de carbone voisin porte 1 proton ;
proton b : multiplet ( les atomes de carbone voisins portent 6 +2 protons).
protons c : multiplet ( les atomes de carbone voisins portent 3 +1 protons).
protons d : triplet ; l'atome de carbone voisin porte 2 protons.
|
|
..
.
|
|
|
2. Synthèse industrielle de l’isoprène.
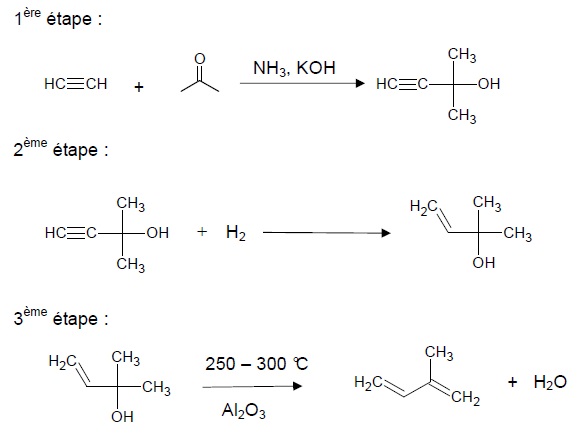
Le chimiste italien Snamprogetti a développé un processus de synthèse
de l’isoprène à partir de propanone et d’éthyne. La première étape se
déroule sous 20 bars entre 10 et 40 °C dans de l’ammoniac liquide avec
comme catalyseur de la potasse de formule KOH.
Le produit, le 2-méthylbut-3-yne-2-ol, est ensuite hydrogéné
sélectivement pour obtenir du 2-méthylbut-3-ène-2-ol. Cette espèce
chimique est ensuite déshydratée à 250-300 °C en présence d’alumine Al 2O3 sous pression atmosphérique pour donner de l’isoprène.
|
|
|
|
2.1. Réaction de synthèse de l’isoprène.
2.1.1. Indiquer, pour les étapes 2 et 3, la catégorie de la réaction.
Etape 2 : addition du dihydrogène sur une triple liaison.
Etape 3 : élimination d'une molécule d'eau.
2.1.2. Déduire de l’ensemble des étapes l’équation de la réaction de synthèse de l’isoprène.
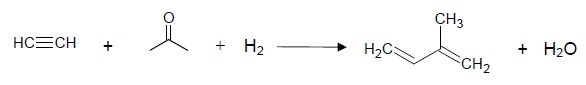
2.2. Ce processus de synthèse a permis de produire, jusqu’en 1982, 30 000 tonnes d’isoprène par an avec un rendement de 85 %.
Déterminer le volume de propanone nécessaire à cette production annuelle sachant que la propanone est le réactif limitant.
M(isoprène) = 5 x12 +8=68 g / mol.
Quantité de matière d'isoprène : 3,0 1010 / 68 =4,41 108 mol.
Quantité de matière de propanone : 4,41 108 mol.
M(propanone) =3 x12 +6 +16) = 58 g / mol.
Masse correspondante : 4,41 108 x 58 =2,56 1010 g
Tenir compte du rendement : 2,56 1010 /0,85 = 3,01 1010 g =3,01 107 kg.
Volume correspondant : 3,01 107 / 790 =3,8 104 m3.
|
|
|
|