Le
lait de chèvre,
bac S Amérique du nord 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
.
.
|
|
L’acide
caprique est un acide gras saturé de longueur de chaîne moyenne,
présent en petites quantités dans le lait de vache et le lait de
chèvre. Par contre, il est abondant dans les huiles tropicales comme
l'huile de noix de coco et l'huile de palmiste. L’acide caprique est,
entre autres, responsable de bienfaits pour la santé attribués à
l'huile de coco.
Cet exercice propose d’étudier la structure et les propriétés
acidobasiques de l’acide caprique et de vérifier, par un titrage, que
le lait de chèvre en contient environ trois fois plus que le lait de
vache.
100 mL de lait de vache contiennent environ 0,09 g d’acide caprique (sous ses différentes formes acidobasiques) ;
ion
|
H3O+
|
Cl-
|
Na+
|
HO-
|
RCOO-
|
l ( mS m2 mol-1)
|
34,96
|
7,63
|
5,01
|
19,8
|
< 4
|
1. Structure et propriétés acidobasiques de l’acide caprique
1.1. Comment
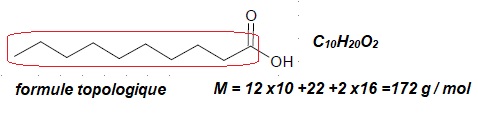
appelle-t-on la représentation donnée ci-dessous de l’acide caprique ?
Recopier la molécule et entourer la chaîne de longueur moyenne évoquée
dans le texte introductif. Vérifier que la masse molaire de l’acide
caprique a pour valeur 172 g.mol-1.
1.2. Représenter un exemple d’acide carboxylique à longueur de chaîne courte et le nommer.
CH3-CH2-COOH acide propanoïque
Par souci de simplification, l’acide caprique sera noté R-COOH dans la suite de l’exercice.
1.3. Définir un
acide au sens de la théorie de Brönsted. Justifier que l’acide caprique
possède des propriétés acido-basiques et donner le couple acide/base
auquel il appartient.
Un acide est une espèce, ion ou molécule susceptible de céder un proton.
L'acide caprique possède un groupe carboxyle COOH suceptible de
libérer un proton. l'acide caprique possède donc des propriétés
acido-basique. Il appartient au couple acide / base RCOOH / RCOO-.
Un producteur de lait souhaite connaître sous quelle forme, acide ou
basique, est présent l’acide caprique dans le lait de chèvre. Une
mesure du pH de ce lait indique la valeur de 6,0.
1.4. Les quantités
des formes acide et basique de l’acide caprique, en solution aqueuse,
dépendent du pH de la solution. À 25 °C, les proportions de ces espèces
en fonction du pH sont données par les courbes de la figure suivante.

1.4.1. Identifier
la courbe correspondant à l’acide caprique et celle correspondant à
l’autre forme du couple et déterminer la valeur du pKa de ce couple en explicitant votre démarche.
A pH = pKa, [RCOOH] = [RCOO-]. pKa = 4,9.
1.4.2. En déduire quelle est la forme acido-basique de l’acide caprique présente majoritairement dans le lait de chèvre.
A pH = 6, valeur supérieure à pKa, la forme RCOO- prédomine.
1.4.3. Une espèce
chimique est considérée comme négligeable devant une autre si sa
concentration molaire est au moins 100 fois inférieure à l’autre. Dans
le cas du lait de chèvre, peut-on négliger une des formes
acido-basiques de l’acide caprique devant l’autre ? Justifier la
réponse.
pH = pKa + log ( [RCOO-] / [RCOOH] ) ; log ( [RCOO-] / [RCOOH] ) = 6-4,9 = 1,1 ;
[RCOO-] / [RCOOH] =101,1 =12,6, valeur inférieure à 100.
On ne peut pas négliger RCOOH devant RCOO-.
|
|
|
|
2. Titrage de l’acide caprique contenu dans le lait de chèvre
L’acide caprique contenu dans le lait de chèvre et sa base
conjuguée ont été extraits afin de reconstituer une solution aqueuse
notée S de même pH que le lait de chèvre.
Il est possible de réaliser le titrage de l’espèce majoritaire contenue
dans 10,0 mL de solution S par une solution titrante de concentration
molaire égale à 1,00 × 10–2 mol.L–1 à choisir entre :
· une solution aqueuse d’acide chlorhydrique (H3O+(aq) , Cℓ–(aq)) ;
· une solution aqueuse d’hydroxyde de sodium (Na+(aq) , HO-(aq)).
2.1. Choisir la solution titrante en justifiant votre choix et établir l’équation de la réaction support du titrage.
RCOO- prédomine dans ce lait. La solution titrante est l'acide chlorhydrique.
RCOO- aq + H3O+ aq ---> RCOOH aq+ H2O.
2.2. Définir l’équivalence d’un titrage et écrire la relation entre les quantités de matière des espèces chimiques mises en jeu.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques. Avant l'équivalence, l'acide
chlorhydrique est en défaut, après l'équivalence, l'acide chlorhydrique
est en excès.
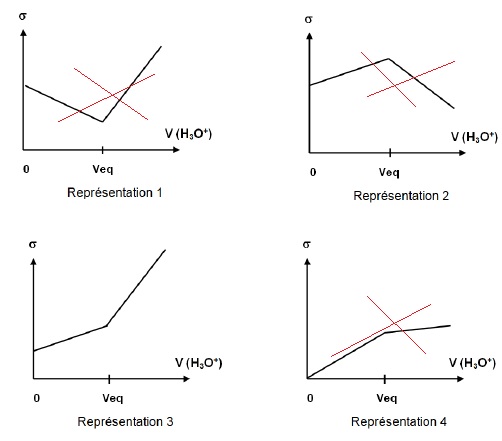
2.3. Choisir parmi
les 4 représentations proposées ci-dessous, celle représentant au mieux
le suivi conductimétrique de l’espèce prédominante contenue dans le
lait de chèvre. Justifier la réponse en faisant notamment un bilan de
l’évolution des espèces ioniques au cours du titrage.
Avant l'équivalence, du point de vue de la conductimétrie, tout ce passe comme si on remplaçait les ions RCOO- par les ion chlorure de conductivité molaire ionique supérieure. La conductivité de la solution croît.
Après l'équivalence, on ajoute des ions H3O+ ( 34,96 mS m2 mol-1) et Cl-, la conductivité croît beaucoup plus rapidement.
2.4. On obtient
lors du titrage un volume de solution titrante versée à l’équivalence
égal à 14,1 mL. Le lait de chèvre contient-il bien trois fois plus
d’acide caprique (sous ses différentes formes acidobasiques) que le
lait de vache ?
Quantité de matière d'ion caprate RCOO- :14,1 10-3 x 1,00 10-2 = 1,41 10-4 mol.
Quantité de matière d'acide caprique RCOOH : 1,41 10-4 / 12,6 =1,12 10-5 mol.
Total : 1,52 10-4 mol.
Masse correspondante : 172 x1,52 10-4 ~2,6 10-2 g dans 10,0 mL soit 0,26 g dans 100 mL.
Or
100 mL de lait de vache contiennent environ 0,09 g d’acide caprique.
Le lait de chèvre contient bien trois fois plus d'acide caprique que le lait de vache.
|
|
|